Предохранительный клапан усл. № Э-216
Предназначен для предотвращения повышения давления в ГР при неисправном регуляторе давления. Установлен между компрессором и ГР. Отрегулирован на срабатывание при давлении 0,9 + 0,02 МПа.
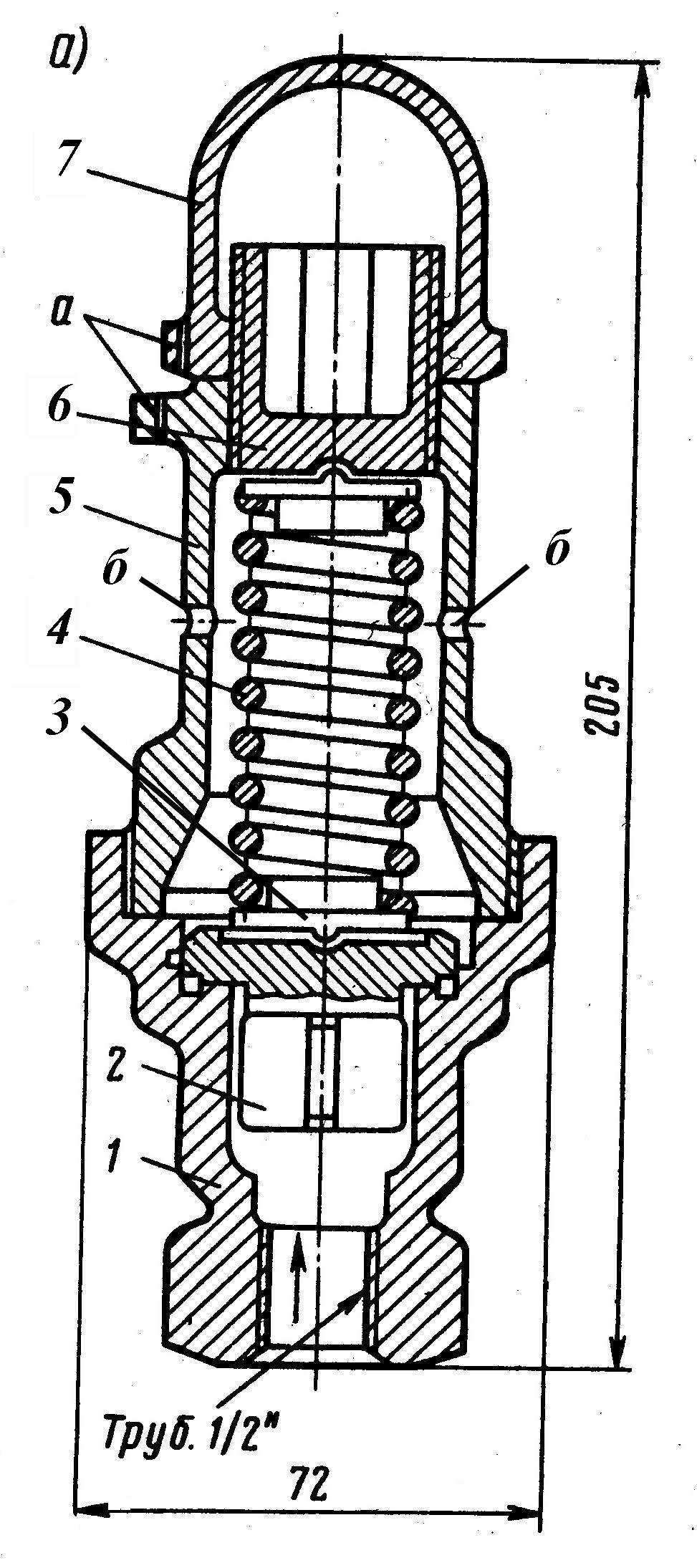
Конструкция клапана усл. № Э-216 представлена на рисунке 7.5.
Штуцер 1; тарельчатый клапан с направляющими ребрами (направляющими перьями) 2; центрирующие шайбы 3; пружина 4; стакан с пломбировочными (а) и атмосферными (б) отверстиями 5; регулировочная гайка 6; колпачок с пломбировочным отверстием 7.
Клапаны должны открываться при превышении рабочего давления не более, чем на 15% и закрываться при уменьшении его не более, чем на 20%
| S1 — рабочая площадь клапана |
| S2 — срывная площадь клапана |
Рисукон 7.5 – Конструкциця клапана усл. № Э-216
Работа клапана(см. рисунок 7.5).
1. При силе F = P · S1 давления сжатого воздуха на рабочую площадь S1 меньше, чем усилие пружины, клапан прижат к седлу (Р — давление, МПа; S1 — площадь рабочей поверхности клапана, мм 2 ).
2. При силе давления сжатого воздуха на рабочую площадь S1 больше, чем усилие пружины, клапан немного отходит от седла, и сжатый воздух проникает под срывную площадь клапана. В результате, сила давления воздуха на клапан возрастает, и клапан поднимается. F = P · (S1 + S2).
3. После выхода излишков сжатого воздуха в атмосферу сила давления на срывную и рабочую поверхности клапана уменьшаются, и клапан под действием пружины прижимается к седлу.
Осмотр, проверка, регулировка усилия сжатия пружин — не реже 1 раза в 3 месяца.
Обратные клапаны.
· Э-155 с резьбой 1½» или Э-155А с резьбой 1¼» – для разгрузки клапанов компрессора от давления сжатого воздуха со стороны ГР при остановке компрессора.
· Э-175 с резьбой ½» для разгрузки клапанов вспомогательного компрессора от давления сжатого воздуха в цепях управления при остановке вспомогательного компрессора при давлении 0,5 МПа.
Устройство обратных клапанов усл. № Э-155 и усл. № Э-175(рисунок 7.6).
Рисунок 7.6 – Обратные клапаны усл. № Э-155 и Э-175
Обратные клапаны имеют следующую конструкцию:
Клапан 1; корпус 2; седло 3; крышка 4; кожаная прокладка 5.
В – камера над клапаном для смягчения его работы.
Принцип действия обратных клапанов:
При подъеме клапана создается воздушная подушка, которая замедляет его подъем; к концу подъема она постепенно рассасывается через неплотность между клапаном и корпусом. При перемещении клапана вниз над ним образуется разряжение, опускание его замедляется и он не успевает сесть на седло до начала следующей пульсации давления в нагнетательной трубе. Если подача воздуха прекращается, то вследствие неплотности между цилиндрической поверхностью клапана и корпусом он под действием собственного веса сядет на седло.
Возможные неисправности клапанов:
1. Клапан работает со стуком:
· увеличен зазор между цилиндрическими поверхностями клапана и корпуса;
2. Клапан пропускает воздух в обратном направлении:
· заедание клапана из-за уменьшенного зазора между цилиндрическими поверхностями клапана и корпуса
Испытание обратных клапанов(рисунок 7.7)
1 – компрессор; 2 – резервуар; 3 – испытуемый обратный клапан;
4 – заглушка с дроссельным отверстием Ø 10 мм
Рисунок 7.7 – Схема испытания обратных клапанов
Отверстие обмыливают. Допускается образование мыльного пузыря, который удерживается не менее 10 секунд.
Источник
Какое упражнение сжигает больше всего калорий за 30 минут?
Бег даже в медленном темпе сжигает много калорий за 30 минут. В среднем бег сжигает от 10.8 до 16 калорий в минуту и ставит его на первое место в списке тренировок, которые сжигают больше всего калорий. Чтобы увеличить сжигание калорий, увеличьте интенсивность или увеличьте интервалы спринта.
Как я могу сжигать 1500 калорий в день? Какие упражнения помогут сжечь 1500 калорий в день?
- Бег. Бег — одно из самых эффективных упражнений для сжигания калорий.
- Езда на велосипеде. Езда на велосипеде — еще один зверь, сжигающий калории.
- Плавание. …
- Скалолазание.
Является ли калория единицей энергии?
Калория единица измерения энергии. … Калория (ккал) – это количество энергии, необходимое для повышения температуры 1 килограмма воды на 1 градус Цельсия. Иногда содержание энергии в пище выражается в килоджоулях (кДж), метрической единице. Одна ккал равна 4.184 кДж.
Джоуль — это моль? Джоуль на моль (обозначение: Дж моль-1 или Дж / моль) составляет производная единица измерения энергии в системе СИ на количество материала. … Так как 1 моль = 6.02214076 × 1023 частиц (атомы, молекулы, ионы и т. д.), 1 джоуль на моль равен 1 джоуля, деленному на 6.02214076 × 1023 частицы, 1.66054×10-24 джоуль на частицу.
Почему родинка 6.022х10 23?
Один моль равен 6.022 × 1023 единицы. Моль — важная единица измерения, потому что в периодической таблице один моль вещества равен его атомная масса в граммах. … Это означает, что 6.022 × 1023 атомы углерода (или молекулы) весят 12.01 грамма.
Как называется 6.022х10 23? Авогадро число, количество единиц в одном моле какого-либо вещества (определяется как его молекулярная масса в граммах), равное 6.02214076 × 1023. Единицами могут быть электроны, атомы, ионы или молекулы, в зависимости от природы вещества и характера реакции (если таковая имеется). См. Также закон Авогадро.
Хлорная кислота и перхлораты
Перхлорат калия KClO4 получают нагреванием хлората калия точно до его температуры плавления
4KClO3 → ЗKClO4 + КСl
Однако в отсутствие катализатора при этой температуре наблюдается лишь незначительное разложение с выделением кислорода. Перхлорат калия образуется также при длительном электролизе раствора хлорида калия, гипохлорита или хлората калия.
Перхлорат калия и другие перхлораты — окислители, но несколько менее энергичные и не столь опасные, как хлораты. Перхлорат калия используют для производства взрывчатых веществ, таких, как порох для базук и других ракет. Этот порох представляет собой смесь перхлората калия, угля и связующих веществ; уравнение основной реакции его горения можно записать в следующем виде:
КСlO4 + 4С → КСl + 4СО
Безводные перхлораты магния Мg(СlO4)2 и бария Ва(СlO4)2 применяют в качестве осушителей. Эти соли очень энергично поглощают воду. Почти все перхлораты хорошо растворимы в воде. Исключением является перхлорат калия, обладающий низкой растворимостью: в 100 г воды при 0°С растворяется только 0,75 г КСlO4. Перхлорат натрия NaСlO4 получают электролитическим методом; его используют для борьбы с сорняками, он менее опасен, чем хлорат натрия. Как правило, смеси перхлоратов с веществами, способными окисляться, менее опасны, чем соответствующие смеси хлоратов.
Хлорная кислота НClO4·Н2O— бесцветная жидкость, образующаяся при перегонке под пониженным давлением раствора перхлората, к которому добавлена серная кислота. Хлорная кислота перегоняется в виде моногидрата и при охлаждении образует кристаллы моногидрата. Эти кристаллы изоморфны кристаллам перхлората аммония NН4СlO4; возможно, что в данном случае образуется вещество, представляющее собой перхлорат гидроксония (Н3O)+ (СlO4)-.
Зависимость количества теплоты от рода вещества
А что будет, если мы будем сравнивать количество теплоты, затраченное на нагревание разных веществ? До этого в наших опытах мы нагревали одинаковую воду в двух сосудах. Давайте проверим.
В первый сосуд нальем воду массой $1 \space кг$, а во второй — керосин массой $1 \space кг$. Горелки, на которых будем нагревать сосуды, одинаковые. Начальные температуры воды и керосина тоже одинаковы. Начнем нагревать эти сосуды (рисунок 3).
Рисунок 3. Демонстрация зависимости количества теплоты от рода вещества.
Через какое-то время (возьмем 3 минуты) зафиксируем температуры веществ в обоих сосудах. Окажется, что керосин будет иметь более высокую температуру, чем вода. При этом отметим, что обе жидкости получили равное количество теплоты.
Значит, для нагревания двух разных веществ до одной и той же температуры требуется разное количество теплоты. В нашем случае для нагрева керосина потребуется меньшее количество теплоты, чем для воды.
Следовательно,
{"questions":,"explanations":,"answer":}},"hints":[]}]}
Крупы отварные и каши
| Название | Ккал | Б | Ж | У |
| рис рассыпчатый | 113.0 | 2.4 | 0.2 | 24.9 |
| каша гречневая рассыпчатая | 163.0 | 5.9 | 1.6 | 80.3 |
| каша гречневая с грибами и маслом | 112.1 | 3.1 | 2.1 | 15.2 |
| каша манная на молоке с маслом — тарелка (200г.) | 128.3 256.6 | ? ? | ? ? | ? ? |
| каша геркулесовая молочная | 105.0 | 3.2 | 4.3 | 14.2 |
| каша геркулесовая на воде | 84.0 | 2.9 | 1.4 | 14.8 |
| каша гречневая вязкая на воде | 90.0 | 3.2 | 0.8 | 17.1 |
| каша манная молочная | 98.0 | 3.0 | 3.2 | 15.8 |
| каша манная на воде | 80.0 | 2.5 | 0.2 | 16.8 |
| каша перловая рассыпчатая | 106.0 | 3.1 | 0.4 | 23.0 |
| каша пшеничная вязкая на воде | 90.0 | 3.0 | 0.7 | 17.0 |
| каша пшенная рассыпчатая | 135.0 | 4.7 | 1.1 | 26.1 |
| каша рисовая молочная | 97.0 | 2.5 | 3.1 | 16.0 |
| каша рисовая на воде | 78.0 | 1.5 | 0.1 | 17.4 |
| фасоль вареная | 123.0 | 7.8 | 0.5 | 21.5 |
| каша овсяная на молоке с сахаром | 76.0 | 3.2 | 3.3 | 8.6 |
| каша манная на молоке с сахаром | 77.0 | 3.1 | 3.0 | 9.4 |
Кислородные кислоты и окислы брома
Бром образует только две устойчивые кислородные кислоты — бромноватистую и бромноватую — и их соли:
НВrО — бромноватистая кислота КВrО — гипобромит калия
НВrO3 — бромноватая кислота КВrO3 — бромат калия
Способы их получения и свойства подобны способам получения и свойствам соответствующих соединений хлора. Они обладают несколько меньшей окислительной способностью, чем аналогичные соединения хлора.
Бромит ион ВrO2— по опубликованным данным существует в растворе. Предпринимавшиеся на протяжении многих лет попытки приготовить бромную кислоту или какой-либо пербромат оказывались безуспешными, и только недавно появилось сообщение о получении бромной кислоты.
Были описаны три крайне неустойчивых окисла брома Вr2O, ВrO2 и Вr3O8. Структура Вr3O8 неизвестна.
Ни одно из кислородных соединений брома не нашло важного практического применения
Хлорноватая кислота и ее соли
Хлорноватая кислота НClO3 — нестойкая кислота, которая так же, как и ее соли, является сильным окислителем. Наиболее важная соль хлорноватой кислоты — хлорат калия KClO3, который получают пропусканием избытка хлора через горячий раствор гидроокиси калия или нагреванием раствора, содержащего гипохлорит-ионы и ионы калия
3 ClO- → СlO3— + 2Сl-
Путем кристаллизации хлорат калия можно отделить от образовавшегося в процессе реакции хлорида калия, так как растворимость хлората при низких температурах значительно меньше растворимости хлорида (3 и 28 г в 100 г воды при 0°С соответственно).
Хлорат калия — кристаллическое белое вещество, применяемое в качестве окислителя при изготовлении спичек и горючих смесей для фейерверков, а также при производстве красок.
Раствор аналогичной соли — хлората натрия NaClO3 — применяют в сельском хозяйстве для борьбы с сорняками. С этой целью можно применять также и хлорат калия, однако натриевые соли дешевле, и по этой причине их шире используют в тех случаях, когда важен только анион. Тем не менее иногда соли натрия не обладают нужными свойствами (они, например, гигроскопичны и поэтому поглощают влагу из воздуха и расплываются); в таких случаях предпочтение отдают солям калия, хотя они и значительно дороже.
Все хлораты в смеси с восстановителями образуют легко взрывающиеся составы; обращаться с ними следует крайне осторожно. Применять хлорат натрия как средство борьбы с сорняками надо с соблюдением мер предосторожности, поскольку горючие материалы, например дерево или одежда, смоченная раствором хлората, после высыхания могут воспламениться от трения
Точно так же весьма опасно измельчать хлорат вместе с серой, древесным углем или другими восстановителями.
Блюда из мяса
| Название | Ккал | Б | Ж | У |
| печенка куриная со сметаной | 245.0 | ? | ? | ? |
| холодец по-деревенски Егорьево | 330.0 | 8.0 | 32.5 | 2.5 |
| говядина отварная | 254.0 | 26.0 | 17.0 | |
| шашлык из свинины | 324.0 | 26.5 | 23.1 | |
| эскалоп | 366.0 | 18.0 | 32.6 | |
| жаркое из телятины | 192.0 | 20.1 | 11.8 | 1.7 |
| котлеты из телятины в панировке | 364.0 | 27.1 | 21.3 | 17.4 |
| рулет из телятины | 250.0 | 16.2 | 14.6 | 14.3 |
| телятина тушеная | 103.0 | 12.5 | 4.0 | 4.0 |
| биточки свиные | 195.0 | 10.4 | 16.1 | 2.6 |
| биточки свиные с овощами | 199.0 | 10.7 | 16.0 | 4.3 |
| жаркое из свинины | 225.0 | 11.4 | 19.8 | 1.2 |
| котлеты из грудинки в панировке | 351.0 | 19.0 | 24.1 | 15.9 |
| ножки свиные заливные | 202.0 | 16.9 | 14.9 | 0.8 |
| ребра свиные тушеные | 210.0 | 7.9 | 19.2 | 2.2 |
| свиная грудинка жареная | 291.0 | 30.4 | 18.7 | 0.7 |
| свинина жареная | 278.0 | 15.4 | 24.4 | |
| свинина отварная | 364.0 | 22.6 | 30.0 | 3.1 |
| стейк из свинины | 472.0 | 21.7 | 42.7 | 1.5 |
| бефстроганов | 219.0 | 19.5 | 14.3 | 3.7 |
| биточки говяжьи | 103.0 | 13.6 | 4.3 | 2.4 |
| бифштекс говяжий деревенский | 258.0 | 19.4 | 19.6 | 1.6 |
| гуляш говяжий | 148.0 | 14.0 | 9.2 | 2.6 |
| жаркое тушеное из говядины | 156.0 | 15.8 | 9.5 | 2.0 |
| котлета говядина+свинина | 284.0 | 13.0 | 21.1 | 11.8 |
Закон Гесса
В 1840 году русский ученый описал закон термохимии, который до сих пор используется. Его называют законом Гесса:
Тепловой эффект зависит от агрегатного состояния начальных и конечных продуктов, промежуточные стадии, не влияют.
Это правило помогает узнать тепловой эффект промежуточных стадий. Он будет равен разнице между начальным и конечным значением. По сумме переходных реакций выясняют общий тепловой эффект.
Тепловой эффект химических реакций
Количество теплоты, которые выделяется или поглощается в результате реакции, называют тепловым эффектом данной реакции.
- обычно обозначают Q
Qp = Qкон. — Qисх.
- выражают в Дж или кДж
2H2(г) + O2(г) = 2H2O(ж) + 484 кДж
Смотри также:
- Классификация химических реакций в неорганической и органической химии
- Скорость химической реакции, ее зависимость от различных факторов
- Обратимые и необратимые химические реакции. Химическое равновесие. Смещение химического равновесия под действием различных факторов
- Электролитическая диссоциация электролитов в водных растворах. Сильные и слабые электролиты
- Реакции ионного обмена
- Гидролиз солей. Среда водных растворов: кислая, нейтральная, щелочная
- Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее
- Электролиз расплавов и растворов (солей, щелочей, кислот)
- Ионный (правило В.В. Марковникова) и радикальный механизмы реакций в органической химии
Единицы количества теплоты
Количество теплоты обозначается буквой $Q$.
Т.к. количество теплоты — это очередной вид энергии, измеряется оно так же в джоулях ($Дж$), килоджоулях ($кДж$) и мегаджоулях ($МДж$):
$1 \space кДж = 1 000 \space Дж$,$1 \space МДж = 1 000 000$,
$1 \space Дж = 0.001 \space кДж$,$1 \space МДж = 0.000001 \space Дж$.
В ходе истории количество теплоты начали измерять задолго до появления понятия энергии в физике. Поэтому существует еще одна единица измерения количества теплоты — калория (кал) или килокалория (ккал). Слово происходит от латинского калор — тепло, жар.
Дадим определение этой единице.
$1 \space ккал = 1 000 \space кал$.
{"questions":,"answer":}},"hints":[]}]}
$1 \space кал = 4.19 \space Дж \approx 4.2 \space Дж$,$1 \space ккал = 4 190 \space Дж \approx 4 200 \space Дж \approx 4.2 \space кДж$.
$1 \space Дж = 0.239 \space кал \approx 0.24 \space кал$,$1 \space Дж = 0.000239 \space ккал \approx 0.00024 \space ккал$.
расчет энергетической ценности
Энергетическая ценность — это количество энергии, которая образуется при биологическом окислении жиров, белков и углеводов, содержащихся в продуктах. Она выражается в килокалориях (ккал) или килоджоулях (кДж)Энергия, выделяемая при окислении 1г жиров, равна 9,0 ккал, 1г углеводов — 3,75 ккал, 1г белков — 4,0 ккал, 1 г органических кислот — 3,0 ккал/г, 1 г этилового спирта — 7,0 ккал/г. Для получения энергетической ценности в единицах системы СИ, надо использовать коэффициент пересчета: 1 ккал = 4,184 кДж. Энергетическая ценность продуктов рассчитывается на 100 г съедобной части. Для определения теоретической калорийности необходимо калорийность питательных веществ умножить на процентное содержание соответствующих питательных веществ. Сумма полученных произведений является теоретическую калорийность 100 г продукта. Зная калорийность 100 г продукта, можно определить калорийность любого его количества (300 г, 1 кг и т.д.). Зная теоретическую калорийность, можно найти практическую (фактическую) калорийность путем умножения результата теоретической калорийности на усвояемость в процентах и деления произведения на 100. Пример Определите теоретическую калорийность 1 стакана (200 г) молока коровьего. По таблице химического состава или по учебнику товароведения находим средний химический состав коровьего молока (в %): жира — 3,2; белков — 3,5; молочного сахара — 4,7; золы — 0,7. Решение. 1. Калорийность жиров в 100 г молока: 9 3,2 = 28,8 ккал. 2. Калорийность белков в 100 г молока: 4 3,5 = 14,0 ккал. 3. Калорийность углеводов в 100 г молока: 3,75 4,7 = 17,6 ккал. 4. Теоретическая калорийность 100 г молока будет равна: 28,8 ккал + 14,0 ккал + 17,6 ккал = 60,4 ккал 5. Теоретическая калорийность 1 стакана (200 г) будет равна: 60,4 2 = 120,8 ккал = 505,4 кДж 6. Фактическая калорийность 100 г молока составляет: (28,8 94) : 100 + (14,0 84,5) : 100 + (17,6 95,6) : 100 = 54,73 ккал = 229 кДж Для того, чтобы изучить потребительские свойства продовольственных товаров, необходимо проанализировать их химический состав и свойства входящих в них химических веществ. По химическому составу и функциональному назначению органические и неорганические вещества, входящие в состав продовольственных товаров, делятся на энергетические, пластические (вода, белки, жиры и др.) и объемно-функциональные (витамины, азотистые и ферменты).
На основании данных о химическом составе продуктов и норм потребления пищевых продуктов определяется ассортимент продуктов, который в каждом отдельном случае может обеспечивать потребность организма в пищевых веществах.
Полезность продуктов питания определяется такими основными потребительскими свойствами, как пищевая, биологическая, энергетическая и физиологическая ценность.
Пищевая ценность продукта характеризует всю полноту полезных свойств, т.е. его доброкачественность, усвояемость, содержание питательных и биологически активных веществ.
Биологическая ценность продуктов характеризуется наличием витаминов, макро- и микроэлементов, незаменимых аминокислот и полиненасыщенных жирных кислот, которые не синтезируются в организме и не могут быть заменены другими пищевыми веществами.
Способность продуктов оказывать влияние на нервную, сердечно-сосудистую, пищеварительную систему человека характеризуют физиологическую ценность продукта.
Наличие жиров, белков, углеводов и их усвояемость характеризуют энергетическую ценность продуктов питания.
Питание для каждого человека является единственным источником энергии, которая необходима для правильного функционирования организма. Сложные вещества, содержащиеся в продуктах питания, расщепляются в организме на более простые вещества, что сопровождается выбросом энергии.
Энергетическая ценность продуктов питания, прежде всего, зависит от содержания в них жира, потому что 1 г этого компонента дает 9 ккал, а 1 г белка и 1 г углеводов вносят по 4 ккал, то есть более чем в два раза меньше, а 1 г клетчатки содержит всего 2 ккал.
Энергетическая ценность пищевых продуктов выражается в Килоджоулях (кДж) или Килокалориях (ккал).
Энергетическая ценность продуктов рассчитывается путем умножения содержания (г) отдельных питательных веществ на следующие коэффициенты преобразования:
- Белок = 17 кДж = 4 ккал;
- Углеводы = 17 кДж = 4 ккал;
- Жир = 37 кДж = 9 ккал;
- Клетчатка = 8 кДж = 2 ккал;
- Органические кислоты = 13 кДж = 3 ккал;
- Этиловый спирт = 29 кДж = 7 ккал;
- Многоатомные спирты (полиолы) = 10 кДж = 2,4 ккал.
Чугунные изделия «Свободного сокола»
Большим монополистом по изготовлению чугунной продукции из ВЧШГ является г.Липецк. На сегодняшний день предприятие включает в себя 19 цехов с современной и развитой инфраструктурой, выпуская более 800 тыс. тонн чугуна в год.

Завод Свободный сокол
Продукция имеет такие отличительные характеристики:
- Чугунные трубы, которые производит ЛМЗ «Свободный сокол», предназначены для коммунальной сферы;
- Изделия имеют высокую прочность;
- В сфере питьевого водоснабжения «Свободный сокол» единственный производитель труб из ВЧШГ в России;
- При изготовлении продукции придерживается всех нормативов и требований ГОСТ;
- Чугунные трубы сертифицированы с соблюдением всех условий по международным стандартам.
На сегодняшний день ЛМЗ «Свободный сокол» — это современное предприятие, которое оснащено специализированным оборудованием от известных мировых производителей, что дает возможность осуществлять поставки продукции не только в регионы России и страны СНГ, но и в Европу и Азию.
За долгие годы опыт применения ВЧШГ доказал, что это уникальный и безупречный сплав, которому нет равных в прочности и антикоррозийной стойкости.
Свойства серого чугуна
Серый чугун
обладает хорошими литейными свойствами (жидкотекучесть, малая объёмная усадка и т.п.) и применяется для изготовления отливок.
Для деталей из серого чугуна
характерна малая чувствительность к влиянию внешних концентраторов напряжения при циклических нагрузках, высокий коэффициент поглощения колебаний при вибрациях деталей (в 2-4 раза выше, чем у стали), высокие антифрикционные свойства (наличие графита улучшает условия смазывания при трении).Перлитный серый чугун обладает также достаточно высокими прочностными свойствами.
Временное сопротивление (или предел прочности) серого чугуна σв зависит от толщины стенок отливки (рисунок С-2
).
Серый чугун очень хрупок из-за пластинчатой формы графитных включений, которые действуют, как многочисленные надрезы в чугуне. Значения предела прочности серого чугуна: 100 МПа для СЧ 10; 350 МПа для СЧ 35.
Улучшить свойства серого чугуна можно при помощи специальных модификаторов.
составить термохимическое уравнение
Взаимодействие веществ принято отражать (записывать) с помощью химического уравнения. Если в таком уравнении указан тепловой эффект, то тогда уравнение будет называться .
Например, обычное уравнение реакции:
А это уже термохимическое уравнение данной реакции:
Уравнение говорит о том, что при взаимодействии 1 моля PbO с 1 молем СО, идущем с образованием 1 моля Pb и 1 моля CO2, выделяется 64 кДж теплоты.
Особенности термохимических уравнений:
1) указывается агрегатное состояние веществ (однако, если все вещества находятся в одном агрегатном состоянии, то его могут не указывать);
2) указывается тепловой эффект реакции в соответствии с ее стехиометрией (то есть, в соответствии с правильно расставленными коэффициентами);
3) тепловой эффект записывается в левой части уравнения;
4) если речь идет о горении вещества, то уравнение составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции называется
5) если речь идет об образовании вещества, то уравнение также составляется по отношению к 1 молю этого вещества; тепловой эффект такой реакции будет называться
А теперь разберем несколько задач, требованием которых является составление термохимического уравнения.
Что нужно сделать для решения таких задач?
1) записать условие задачи;
2) составить уравнение реакции;
3) вычислить ее тепловой эффект;
4) записать полученное значение теплового эффекта в уравнение реакции.
Пример 1. Кальций массой 8 г сгорает с выделением 127 кДж теплоты. Напишите термохимическое уравнение (тху) реакции.
Пример 2. При разложении 6,86 г оксида ртути (II) тратится 3,64 кДж тепловой энергии. Напишите термохимическое уравнение (тху) реакции.
Пример 3. Реакция 6 г углерода с водородом приводит к выделению 37,42 кДж теплоты. Напишите термохимическое уравнение (тху) реакции образования метана.
Как уменьшается калорийность продуктов?
Среди продовольственных товаров есть много продуктов с пониженным значением энергетической ценности. Их калорийность снижена за счет уменьшения содержания в них жиров и сахара. Другой способ уменьшить калорийность пищи заменить сахар и жир веществами, с низким или нулевым значением энергии.
Например, сахар можно заменить на подсластители полиолы (ксилит, мальтит), которые имеют более низкую калорийность от натурального сахара (около 40%) или синтетические вещества интенсивные подсластители (например, аспартам, тауматин), которые не имеют калорий. Следует отметить, что существуют определенные нормы, которые регулируют подсластители, в какой дозе и в каких продуктах допускается их использование.
Кислородные кислоты и окислы иода
Иод реагирует с ионом гидроксила в холодном щелочном растворе с образованием гипоиодит-иона IO- и иодид-иона
I2 + 2OН- → IO- + I- + Н2O
При нагревании раствора реакция идет дальше до образования йодат-иона IO3—
3IO- → IO3— +2I-
Таким методом можно получать и соли иодноватистой (НIO) и йодноватой (НIO3) кислот. Йодноватую кислоту НIO3 обычно получают окислением иода концентрированной азотной кислотой
I2 + 10HNO3 → 2НIO3 + 10NО2 +4Н2O
Йодноватая кислота является твердым белым веществом, очень мало растворимым в концентрированной азотной кислоте; вследствие этого ее легко можно выделить в процессе реакции. Главные ее соли — йодат калия КIO3 и йодат натрия NaIO3 — белые кристаллические вещества.
Рис. 8.2. Периодат-ион IO65-.
Йодная кислота имеет нормальную формулу Н5IO6 с октаэдрическим расположением атомов кислорода вокруг атома иода, как показано на рис. 8.2. Такое различие в составе этой молекулы и аналогичной молекулы хлорной кислоты НClO4 обусловлено большими размерами атома иода, вокруг которого могут разместиться шесть атомов кислорода вместо четырех. Координационное число иода в йодной кислоте равно, следовательно, 6.
Существует ряд периодатов, отвечающих формуле Н5IO6 для йодной кислоты, и второй ряд, отвечающий формуле НIO4. К первому ряду относятся К2Н3IO6, Аg5IO6 и др. Периодат натрия NaIO4 — соль, относящаяся ко второму ряду; в небольших количествах она содержится в чилийской селитре.
В обеих формах йодной кислоты Н5IO6 и НIO4 (неустойчивая форма, дающая, однако, устойчивые соли) иод находится в одной и той же степени окисления +7. Равновесие между двумя формами этой кислоты определяется реакцией гидратации
НIO4 + 2Н2O ⇔ Н5IO6
Пятиокись (пентоксид) иода I2O5 или йодноватый ангидрид получают в виде белого порошка при медленном нагревании йодноватой или йодной кислоты
2НIO3 → I2O5 + Н2O
2Н5IO6 → I2O5 + 5Н2O + O2
По-видимому, ангидрид йодной кислоты I2O7 неустойчив; сообщений о его получении не было.
Низший окисел иода IO2 можно получить обработкой солей йодноватой кислоты (йодатов) концентрированной серной кислотой с последующим добавлением воды. Этот окисел представляет собой желтое твердое вещество, обладающее парамагнитными свойствами.
Термохимическое уравнение
Химические уравнения, в которых отображается тепловой эффект называются термохимическими. При записи в скобках обязательно указывают агрегатное состояние вещества: твердое, жидкое, газообразное и другое. Коэффициенты прописываются в условии: дробные или цельные числа.
При расчете учитывают температуру и давление, при которых протекает процесс. Если в условиях задачи не прописаны значения, то их принимают как стандартные: температура 278К, а давление 110,3 кПа.
В конце записи химического уравнения записывают значение Q, которое берут в справочнике, отдельно для каждого вещества. Энергия представлена в кДж в стандартных условиях. Применяется для расчета по формулам.
Практика
Рассмотрим несколько термохимических расчетов для типовых заданий.
Задача 1
Рассчитайте количество теплоты, выделившейся в результате реакции образования метана, термохимическое уравнение которой —
C(тв) + 2H2 (г) = CH4 (г) + 76 кДж,
из: а) 0,3 моля углерода; б) 2,4 г углерода; в) 2,24 л водорода.
Решение.
Важно помнить, что количество теплоты, которая выделяется в результате реакции, пропорционально количеству вещества, вступившего в реакцию. а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется x кДж
а) Из термохимического уравнения видно, что при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,3 моля С выделяется x кДж.
Составим уравнение и решим его:
1 моль × х = 76 кДж × 0,3 моля;
.
б) Для начала найдем количество вещества прореагировавшего углерода. Для этого разделим его массу m на молярную массу M:
.
Молярная масса углерода равна 12 г/моль (значение из таблицы Менделеева).
Тогда .
В соответствии с термохимическим уравнением при взаимодействии 1 моля С выделяется 76 кДж, тогда при взаимодействии 0,2 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,2 моля;
.
в) Для начала найдем количество вещества вступившего в реакцию водорода. Для этого разделим его объем V на молярный объем Vm:
.
Молярный объем любого вещества равен 22,4 л/моль.
Тогда .
В соответствии с термохимическим уравнением при взаимодействии 2 молей H выделяется 76 кДж, тогда при взаимодействии 0,1 моля выделяется х кДж.
Данной пропорции соответствует уравнение:
1 моль × х = 76 кДж × 0,1 моля;
.
Задача 2
В результате реакции, термохимическое уравнение которой —
2H2 (г) + O2 (г) = 2H2O (г) + 484 кДж,
выделилось 1 360 кДж. Вычислите: а) объем (н. у.) вступившего в реакцию кислорода; б) массу образовавшейся воды.
Решение.
а) В соответствии с термохимическим уравнением при взаимодействии
1 моля кислорода выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
1 моль × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
V = n(H) × Vm, где Vm — молярный объем;
V(H) = 2,81 моля × 22,4 л/моль = 62,95 л.
б) В соответствии с термохимическим уравнением при взаимодействии
2 молей воды выделяется 484 кДж, тогда при взаимодействии
х молей кислорода выделяется 1 360 кДж.
Этой пропорции соответствует уравнение:
2 моля × 1 360 кДж = 484 кДж × х молей;
.
Найдем объем вступившего в реакцию кислорода, воспользовавшись формулой:
m(H2O) = n(H2O) × M(H2O), где M — молярная масса;
M(H2O) = 1 × 2 + 16 × 1 = 18 г/моль;
m(H2O) = 5,62 моля × 18 г/моль = 101,16 г.
Еще больше задач, да еще и в интерактивном формате — на онлайн-курсах по химии в школе Skysmart.
Свойства
Технологические

- Температура обработки давлением: начальный показатель — 1260, конечный — 750. Заготовки, имеющие сечение размером 200 мм, остывают при комфортной температуре 22–20 °C, сечением 202–710 мм получают отжиг низкими температурами.
- Обработка резанием — Kv тв.спл = 1,3 и Kv б.ст = 1,7 в горячекатаном положении имеет НВ 131 σв = 460 мегапаскаль.
- Склонность стали к поражению флокенами (дефекты внутри) — малочувствительна. Снижение пластичности закаленной легированной стали — не склонна.
Физические
Число теплопроводности, количество теплоты, проходящей в течение единицы времени через единицу вещества при температуре по Цельсию:
| Сталь | Двадцать | Сто | Двести | Триста | Четыреста | Пятьсот | Шестьсот | Семьсот | Восемьсот | Девятьсот |
| 20Х | 216 | 214 | 198 | 192 | 181 | 173 | 165 | 142 | 133 | — |
Число расширения при воздействии теплом, температура опытов по Цельсию:
| 20–100 | 20–200 | 20–300 | 20–400 | 20–500 | 20–600 | 20–700 | 20–800 | 20–900 | 20–1000 |
| 11,5 | 11,9 | 13,4 | 13,8 | 13,9 | 15,0 | — | — | — | — |
Отношение теплоёмкости к массе джоуль / (килограмм × кельвин), температура в градусах Цельсия:
| 20–100 | 20–200 | 20–300 | 20–400 | 20–500 | 20–600 | 20–700 | 20–800 | 20–900 | 20–1000 |
| 496 | 507 | 524 | 536 | 566 | 587 | 625 | 706 | — | — |
Число нормативной силы пластичности, упругости Е, гигапаскаль, температура в градусах Цельсия:
| Сталь | Двадцать | Сто | Двести | Триста | Четыреста | Пятьсот | Шестьсот | Семьсот | Восемьсот | Девятьсот |
| 20Х | 215 | 212 | 197 | 194 | 180 | 170 | 164 | 142 | 132 | — |
Модуль мощи пластичности с дисбалансом на вращение G, гигапаскаль, температура в градусах Цельсия:
| Сталь | Двадцать | Сто | Двести | Триста | Четыреста | Пятьсот | Шестьсот | Семьсот | Восемьсот | Девятьсот |
| 20Х | 84 | 82 | 78 | 75 | 72 | 66 | 63 | 57 | 51 | — |
Тепловой эффект химической реакции
Тепловой эффект – это количества тепла или энергии, которое выделилось или поглотилось во время химической реакции, относительно 1 моль вещества. В химии тепловой эффект обозначают символом Q, измеряют в ккал/моль или кДж/моль. Согласно определению выделяют два типа процессов:
- Экзотермические реакции – протекают с выделением тепла, процесс происходит быстро, в конце реакции записывается, как +Q.
- Эндотермические реакции – протекают с поглощением тепла. Чтобы получить конечный продукт, реагенты нагревают. Процессы занимают много времени. В конце реакции обозначаются, как –Q.
Чем больше прореагирует химического вещества, тем больше выделиться энергии. Следовательно, тепловой эффект зависит от химического вещества в моль вступившего в реакцию.
|
Экзотермическая реакция |
|
| Эндотермическая реакция |
|
По энергии ионизации реагенты в эндотермической реакции находятся выше оси нулевой энергии, т.е. скорость прямой реакции выше, чем обратной и наоборот, в эндотермических реакциях – скорость обратной реакции выше, чем прямой.


































