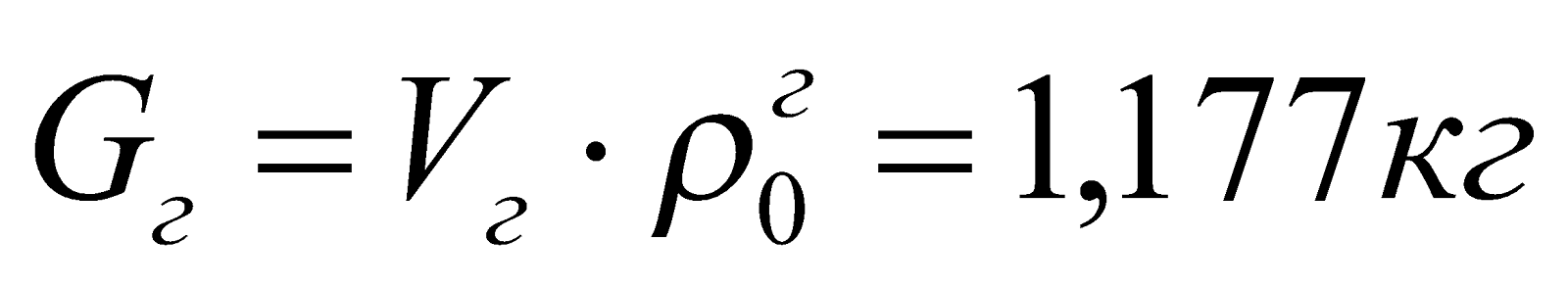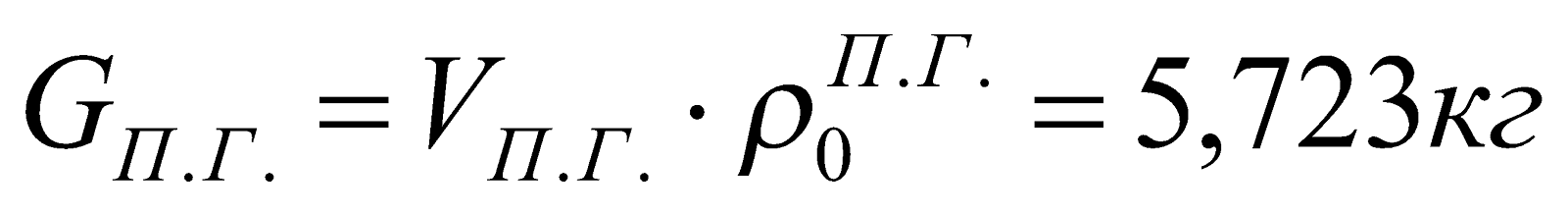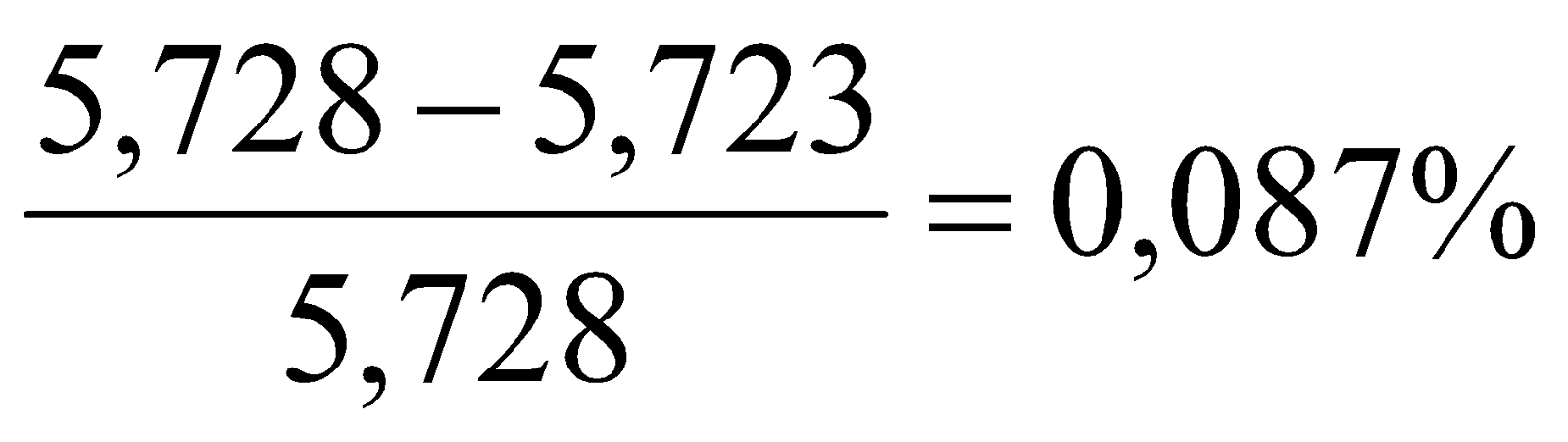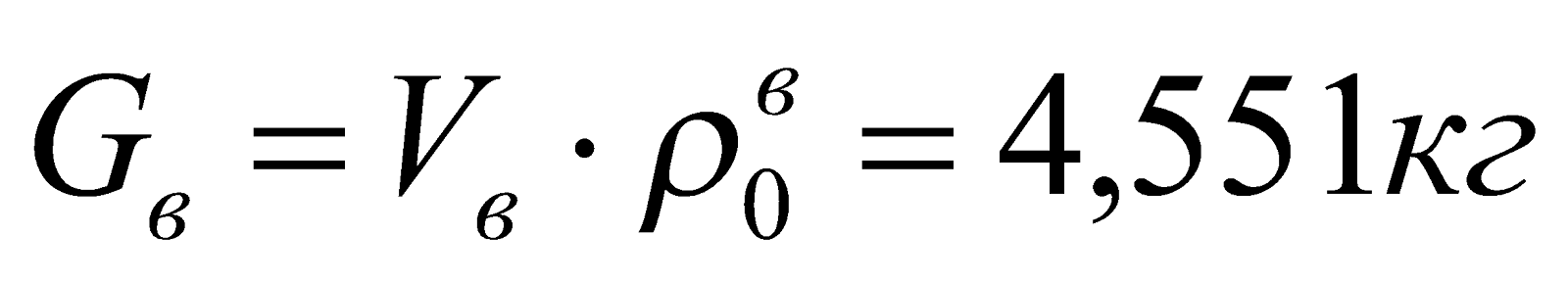Соотношение с основными и кратными единицами мощности
Ватт относится к производной единице измерения мощности, поэтому на практике иногда необходимо определять значение параметра по отношению к основным единицам международной системы СИ. В технических расчетах используются следующие соответствия основным значениям:
- W = кгм² / с³;
- L = Гм / с;
- W = VA
Параметр имеет универсальное применение и одинаково используется в технических разработках различных сфер деятельности.
Теплотехника использует единицы, не входящие в систему СИ, для измерения тепловой мощности в 1 кал / час. Наше рассмотренное значение связано с ним соотношением: 1 Вт = 859,85 кал / час.
Часто для удобства работы с большими значениями мощности электростанций и групп мощности слово ват может использоваться с приставками «мега» или «гига»:
- мегаватт обозначается MW / MW и соответствует 106 Вт;
- гигаватт (сокращенно GW / GW) равен 109 Вт.
Напротив, в слаботочных информационных сетях, электронных устройствах и современном электронном оборудовании мощность измеряется долями ватт:
- милливатты (мВт, мВт) – 10-3 Вт;
- микроватты (мкВт, мкВт) равны 10-6 Вт.
Используя эти соотношения, всегда можно перевести большинство параметров в требуемые силовые агрегаты.
Как правильно переводить эти единицы
Ватт равен килограмму на квадратный метр, разделенному на кубические секунды. Приставка кило означает умножение на 1000. Тот же принцип применяется к индикаторам мощности, то есть 1 кВт равен 1000 Вт и 1000 вольт. Это означает, что 1 единица = 0,001 субъединицы. То есть, если сделать передачу мощности, электроприбор на 3 кВт будет равен 3000 Вт.
Вам будет интересно, на какую мощность рассчитан станок 16а
Формула перевода
В электричестве
Для упрощения измерений в электричестве используется подблок. Вы можете узнать, сколько ватт в киловаттах, и преобразовать единицы, умножив ватты на 103 и разделив на 1000. Для выполнения обратного преобразования вам необходимо умножить киловатты на 103 или умножить известные показатели на 1000.

Сумма в электричестве
В отоплении
Для измерения тепловой мощности необходимо использовать джоули. Это работа, которую проделывает 1 ньютон на 1 метр. Чтобы преобразовать джоули в киловатты, вам нужно использовать субъединицу джоулей. В 1 кДж содержится 0,239 ккал. В 1 ккал 4,1868 кДж. В 1 кВт содержится 860 ккал. Это означает, что 1000 ккал – это 1163 кВт в час.
Тепловые меры
Горение топлива.
Горением называют химический процесс соединения топлива с окислителем, сопровождающийся интенсивным тепловыделением и быстрым подъемом температуры продуктов сгорания.
Объем движущихся газов, в котором совершаются процессы горения, называется пламенем.
В зависимости от величины коэффициента расхода n (отношение действительного расхода к теоретическому), условий смешения окислителя и топлива, горение топлива бывает полное или неполное.
-
Полное горение топлива получается при n ≥ 1 и полном смешении топлива с окислителем.
Продуктами полного горения являются СО2, Н2О, SO2,.
-
Неполное горение:
-
химический недожог получается при n ≤ 1;
-
механический недожог получается при n ≥ 1 из-за плохого смешения окислителя с топливом, кроме того, унос частиц с газом, провалом твердого топлива сквозь колосниковую решетку.
Неполное горение вызывает потерю тепла (топлива). При неполном горении в продуктах горения наряду с CO2, O2, SO2, H2O, N2 содержится CO, H2, CH4.
Следует помнить, что основную роль для обеспечения полного сжигания топлива при n ≥ 1 играет стадия смешения топлива с окислителем.
Горение газообразного топлива.
Процесс горения любого топлива разделяется на две стадии: воспламенение и непосредственное горение.
Полное сгорание основных горючих составляющих газообразных топлив происходит по следующим реакциям:
CH4 + 2O2 = CO2 + 2H2O + 8580ккал/нм3;
H2 + ½O2 = H2O + 2580ккал/нм3;
CO + ½O2 = CO2 + 3022ккал/нм3.
Неполное горение метана:
СН4 + ½О2 = СО + 2Н2 + 396ккал/нм3.
Горение газообразного топлива бывает кинетическое и диффузорное:
-
под кинетическим горением понимают горение газовой смеси горючего и окислителя; в этом случае полное время процесса определяется только скоростью химической реакции;
-
при диффузорном горении процессы смешения и горения происходят в одном объеме; лимитирующим процессом является процесс смешения – физический процесс, протекающий с меньшей скоростью, чем собственно процесс горения.
Горение жидкого топлива.
В условиях промышленных печей жидкое топливо (обычно мазут) сжигают в распыленном состоянии. Кинетика горения: жидкое топливо, распыленное до мелких капель, попадая в пространство печи, нагретое выше температуры самовоспламенения, начинает испаряться, дальше смешивается с окислителем и горит.
Горение твердого топлива.
Процесс горения твердого топлива может быть разделен на следующие стадии:
-
подогрев и подсушка топлива;
-
процесс пирогенного разложения топлива с выделением летучих и образованием коксового остатка;
-
горение летучих, горение коксового остатка (углерод).
Полное горение углерода:
С + О2 = СО2 + 7980ккал/(кг оС);
Неполное горение углерода:
2С + О2 = 2СО + 2340ккал/(кг оС).
Работа и мощность постоянного тока. Закон Джоуля-Ленца
Подробности Работа тока — это работа электрического поля по переносу электрических зарядов вдоль проводника; Работа тока на участке цепи равна произведению силы тока, напряжения и времени, в течение которого работа совершалась.
Применяя формулу закона Ома для участка цепи, можно записать несколько вариантов формулы для расчета работы тока:
По закону сохранения энергии:
работа равна изменению энергии участка цепи, поэтому выделяемая проводником энергия равна работе тока.
В системе СИ:
ЗАКОН ДЖОУЛЯ -ЛЕНЦА
При прохождениии тока по проводнику проводник нагревается, и происходит теплообмен с окружающей средой, т.е. проводник отдает теплоту окружающим его телам
Количество теплоты, выделяемое проводником с током в окружающую среду, равно произведению квадрата силы тока, сопротивления проводника и времени прохождения тока по проводнику.
По закону сохранения энергии количество теплоты, выделяемое проводником численно равно работе, которую совершает протекающий по проводнику ток за это же время.
В системе СИ:
= 1 Дж
МОЩНОСТЬ ПОСТОЯННОГО ТОКА
— отношение работы тока за время t к этому интервалу времени.
В системе СИ:
Следующая страница «Электрический ток в металлах. Сверхпроводимость»
Назад в раздел «10-11 класс»
Электростатика и законы постоянного тока — Класс!ная физика
Электрический заряд. Электризация. Закон сохранения электрического заряда. Закон Кулона. Единица электрического заряда — Близкодействие и дальнодействие. Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей. Силовые линии электрического поля — Проводники и диэлектрики в электростатическом поле. Поляризация диэлектриков — Потенциальная энергия тела в электростатическом поле. Потенциал электростатического поля и разность потенциалов. Связь между напряженностью электростатического поля и разхностью потенциалов — Электроемкость. Конденсаторы. Энергия заряженного конденсатора — Электрический ток. Сила тока. Условия, необходимые для существования электрического тока. Закон Ома для участка цепи. Сопротивление — Работа и мощность тока
Кратные и дольные единицы
В соответствии с полным официальным описанием СИ, содержащемся в действующей редакции Брошюры СИ (фр. Brochure SI
), опубликованной Международным бюро мер и весов (МБМВ), десятичные кратные и дольные единицы джоуля образуются с помощью стандартных приставок СИ. «Положение о единицах величин, допускаемых к применению в Российской Федерации», принятое Правительством Российской Федерации, предусматривает использование в тех же приставок.
| Кратные | Дольные | ||||||
| величина | название | обозначение | величина | название | обозначение | ||
| 101 Дж | декаджоуль | даДж | daJ | 10−1 Дж | дециджоуль | дДж | dJ |
| 102 Дж | гектоджоуль | гДж | hJ | 10−2 Дж | сантиджоуль | сДж | cJ |
| 103 Дж | килоджоуль | кДж | kJ | 10−3 Дж | миллиджоуль | мДж | mJ |
| 106 Дж | мегаджоуль | МДж | MJ | 10−6 Дж | микроджоуль | мкДж | µJ |
| 109 Дж | гигаджоуль | ГДж | GJ | 10−9 Дж | наноджоуль | нДж | nJ |
| 1012 Дж | тераджоуль | ТДж | TJ | 10−12 Дж | пикоджоуль | пДж | pJ |
| 1015 Дж | петаджоуль | ПДж | PJ | 10−15 Дж | фемтоджоуль | фДж | fJ |
| 1018 Дж | эксаджоуль | ЭДж | EJ | 10−18 Дж | аттоджоуль | аДж | aJ |
| 1021 Дж | зеттаджоуль | ЗДж | ZJ | 10−21 Дж | зептоджоуль | зДж | zJ |
| 1024 Дж | иоттаджоуль | ИДж | YJ | 10−24 Дж | иоктоджоуль | иДж | yJ |
| применять не рекомендуется |
Удельная теплота сгорания жидкого топлива (спирта, бензина, керосина, нефти)
Приведена таблица удельной теплоты сгорания жидкого топлива и некоторых других органических жидкостей. Следует отметить, что высоким тепловыделением при сгорании отличаются такие топлива, как: бензин, авиационный керосин, дизельное топливо и нефть.
Удельная теплота сгорания спирта и ацетона существенно ниже традиционных моторных топлив. Кроме того, относительно низким значением теплоты сгорания обладает жидкое ракетное топливо и этиленгликоль — при полном сгорании 1 кг этих углеводородов выделится количество теплоты, равное 9,2 и 13,3 МДж, соответственно.
| Топливо | Удельная теплота сгорания, МДж/кг |
|---|---|
| Ацетон | 31,4 |
| Бензин А-72 (ГОСТ 2084-67) | 44,2 |
| Бензин авиационный Б-70 (ГОСТ 1012-72) | 44,1 |
| Бензин АИ-93 (ГОСТ 2084-67) | 43,6 |
| Бензол | 40,6 |
| Дизельное топливо зимнее (ГОСТ 305-73) | 43,6 |
| Дизельное топливо летнее (ГОСТ 305-73) | 43,4 |
| Жидкое ракетное топливо (керосин + жидкий кислород) | 9,2 |
| Керосин авиационный | 42,9 |
| Керосин осветительный (ГОСТ 4753-68) | 43,7 |
| Ксилол | 43,2 |
| Мазут высокосернистый | 39 |
| Мазут малосернистый | 40,5 |
| Мазут низкосернистый | 41,7 |
| Мазут сернистый | 39,6 |
| Метиловый спирт (метанол) | 21,1 |
| н-Бутиловый спирт | 36,8 |
| Нефть | 43,5…46 |
| Нефть метановая | 21,5 |
| Толуол | 40,9 |
| Уайт-спирит (ГОСТ 313452) | 44 |
| Этиленгликоль | 13,3 |
| Этиловый спирт (этанол) | 30,6 |
Топливо и его горение
Основным источником энергии для металлургической промышленности является топливо.
Под топливом понимают вещество, горение которого сопровождается выделением значительного количества тепла и которое отвечает следующим требованиям:
-
запасы должны быть достаточными для того, чтобы их было экономически выгодно добывать и попользовать;
-
продукты сгорания должны легко удаляться из зоны горения;
-
продукты сгорания должны быть безвредны для окружающего мира и самих тепловых устройств;
-
процесс горения должен быть легко управляем.
Этим требованиям отвечают органические соединения, содержащие углерод С и водород Н и их соединения.
Все виды топлива подразделяют на естественное и искусственное, каждое из которых в свою очередь подразделяются на твердое, жидкое, газообразное.
Химический состав топлива.
Топливо состоят из горючей массы и балласта. К горючим компонентам относятся С, Н, S (сера органическая и колчеданная). В состав топлива входят азот N (не горит, теплоноситель), кислород О (окисляет горючие компоненты).
Кроме этого в топливе всегда присутствуют вода и зола. Вода, содержащаяся в топливе, подразделяется на гигроскопическую, химически связанную и внешнюю, которая механически удерживается в топливе и теряется при сушке.
Зола – это негорючая минеральная часть топлива, состоящая из Al2O3, Fe2O3, Si2O3, CaO и др.
Элементарный анализ топлива.
|
Индекс |
Состав |
|||||
|
C |
H |
O |
N |
S |
A |
W |
|
О |
органическая масса |
|||||
|
Г |
горючая масса |
|||||
|
С |
сухая масса |
|||||
|
Р |
рабочая масса |
Состав рабочего топлива:
СР + HР + OР + NР + SР + AР + WР = 100%
Пересчет состава топлива с любой массы на рабочее топливо выполняется по одному из следующих выражений:
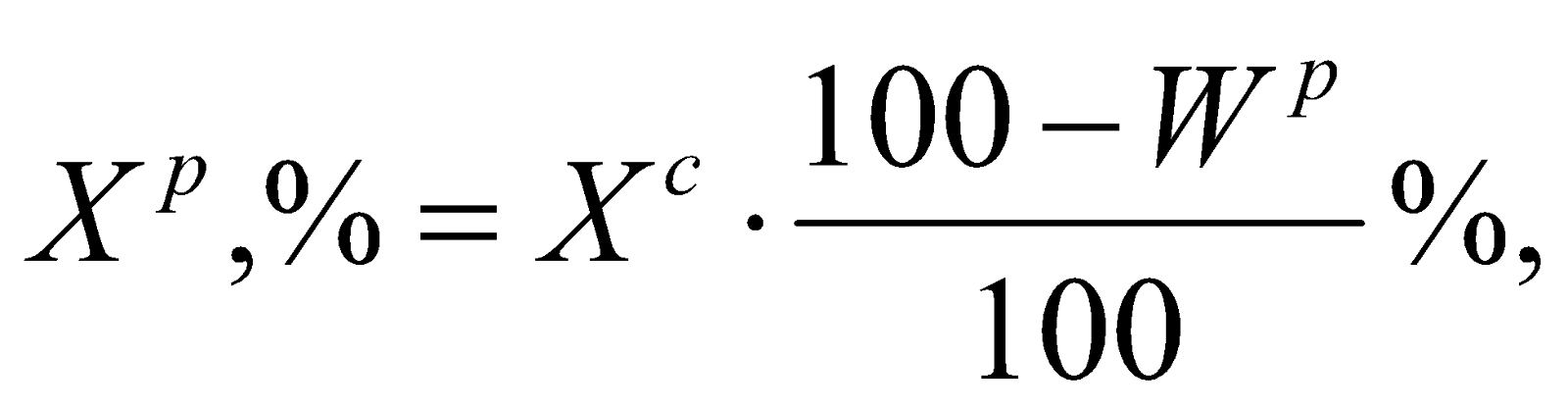
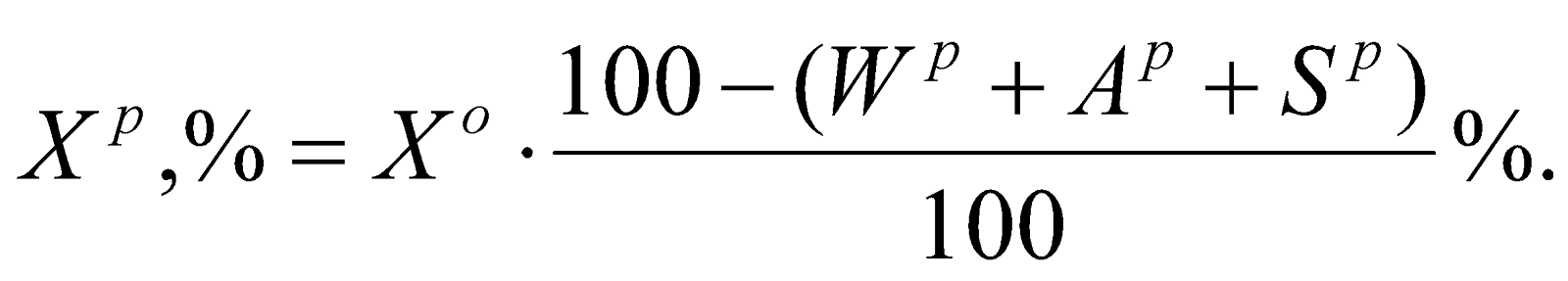
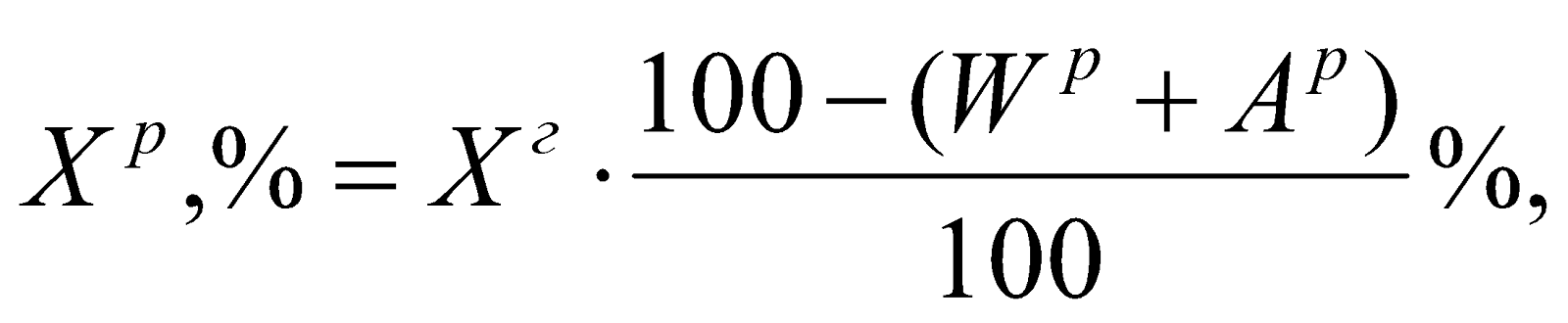
Теплота сгорания топлива.
Количество выделившегося тепла при сжигании топлива связано с химическим составом топлива.
Количество тепла, которое выделяется при сжигании единицы топлива, называется теплотой сгорания топлива Q. Ее размерности: кДж/кг (ккал/кг), кДж/м3 (ккал/м3) или кДж/кмоль (ккал/кмоль).
В технике различают высшую Qв и низшую Qн теплоту сгорания топлива. Под низшей теплотой сгорания понимают то количество тепла, которое выделяется при сжигании единицы топлива до продуктов полного сжигания при условии, что вода, содержащаяся в продуктах сгорания, находится в виде пара, охлажденного до 20оС.
Теплота сгорания топлива определяется по следующим формулам:
для твердого и жидкого топлива:
![]()
для газообразного:
![]()
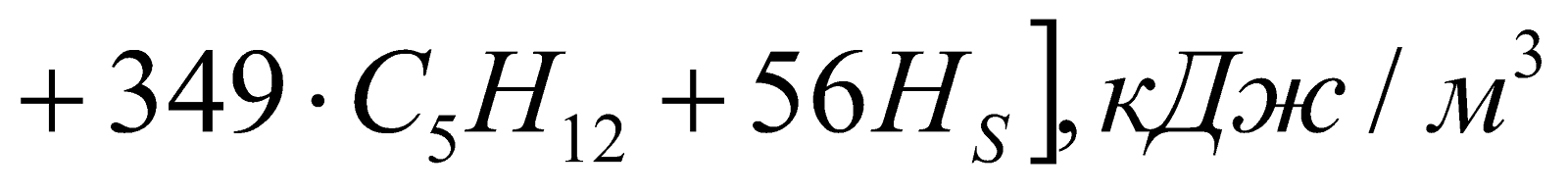 ,
,
где CP, HP, CO, H2 и т.д. – составляющие топлив, %;
4, 187кДж = 1ккал.
Условное топливо.
Для удобства планирования, учета и сравнения различных видов топлива введено понятие условного топлива, которое характеризуется низшей теплотой сгорания
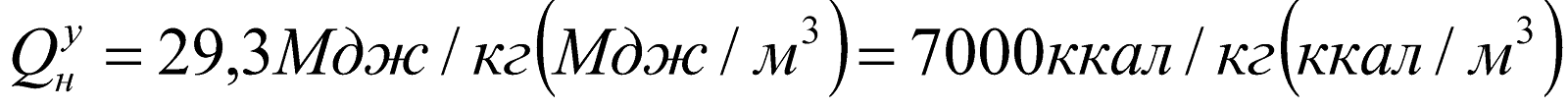 .
.
Для перевода натурального топлива в условное находится эквивалент данного топлива:
для твердого и жидкого:
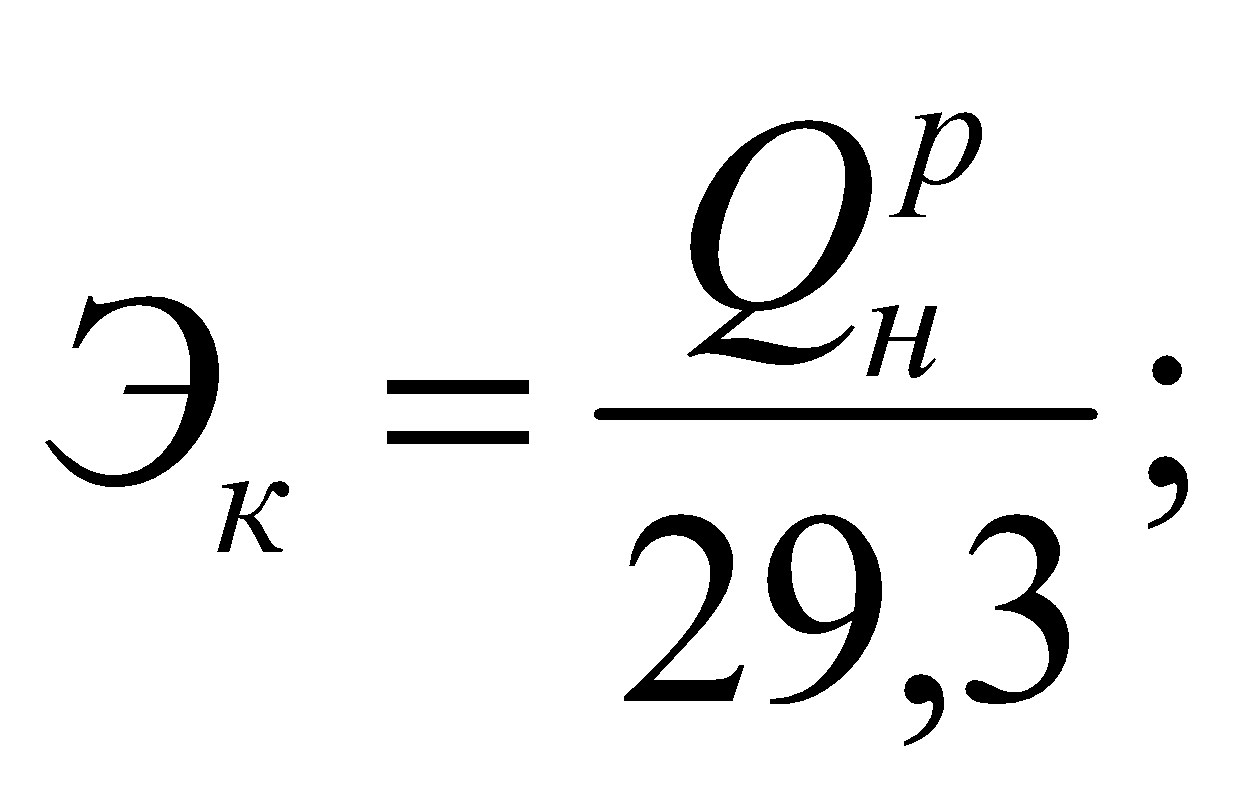
для газообразного:
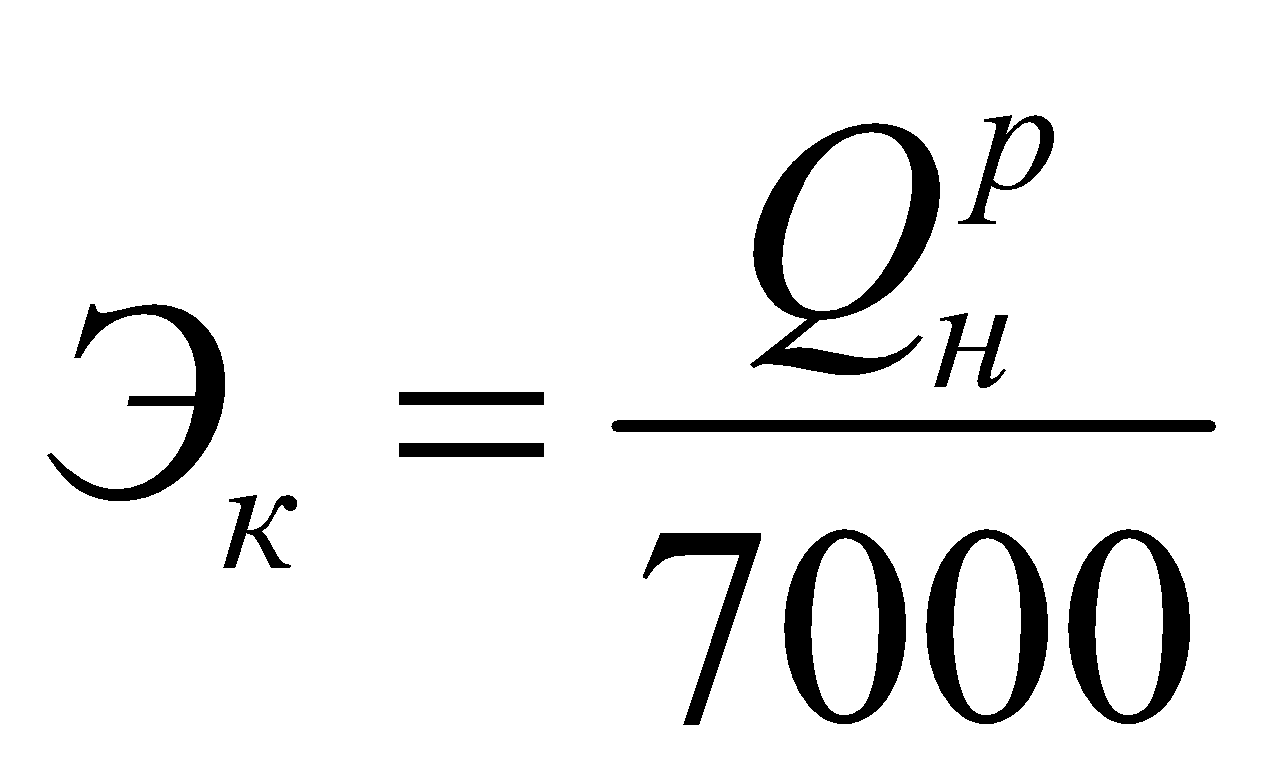 .
.
Перерасчет расхода натурального топлива Вр на условное Ву осуществляется по формуле:
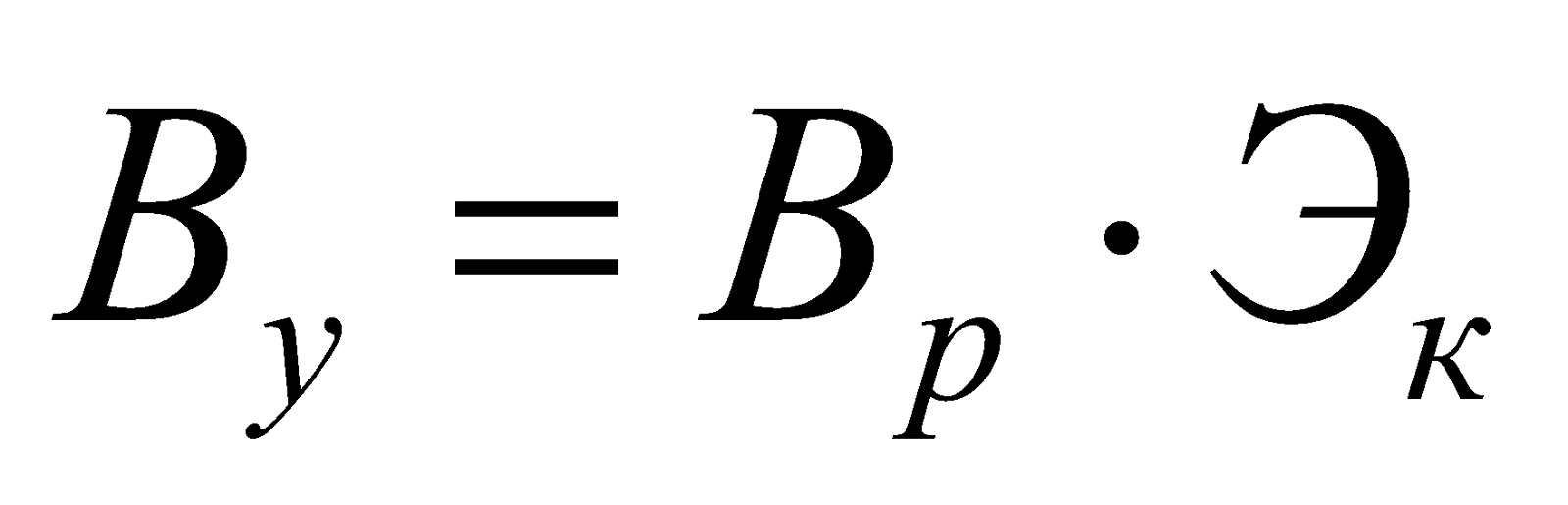
Газообразное топливо.
Газообразное топливо по сравнению с твердым и жидким топливом обладает следующими преимуществами:
-
возможностью лучшего смешения газа с воздухом и, следовательно, сжиганием с меньшим избытком воздуха;
-
легкостью подогрева перед сжиганием;
-
отсутствием золы;
-
транспортабельностью и удобством учета расхода газа;
-
простотой обслуживания горелочных устройств.
Недостатки: взрывоопасность, малая объемная масса (требуются большие емкости для хранения).
Природный газ – наиболее дешевое топливо. Его основным горючим компонентом является метан CH4 = 95%.
Искусственные газы:
-
коксовый газ – продукт коксования углей;
горючие компоненты – Н2 = 46-60%; СН4 = 20-30%; 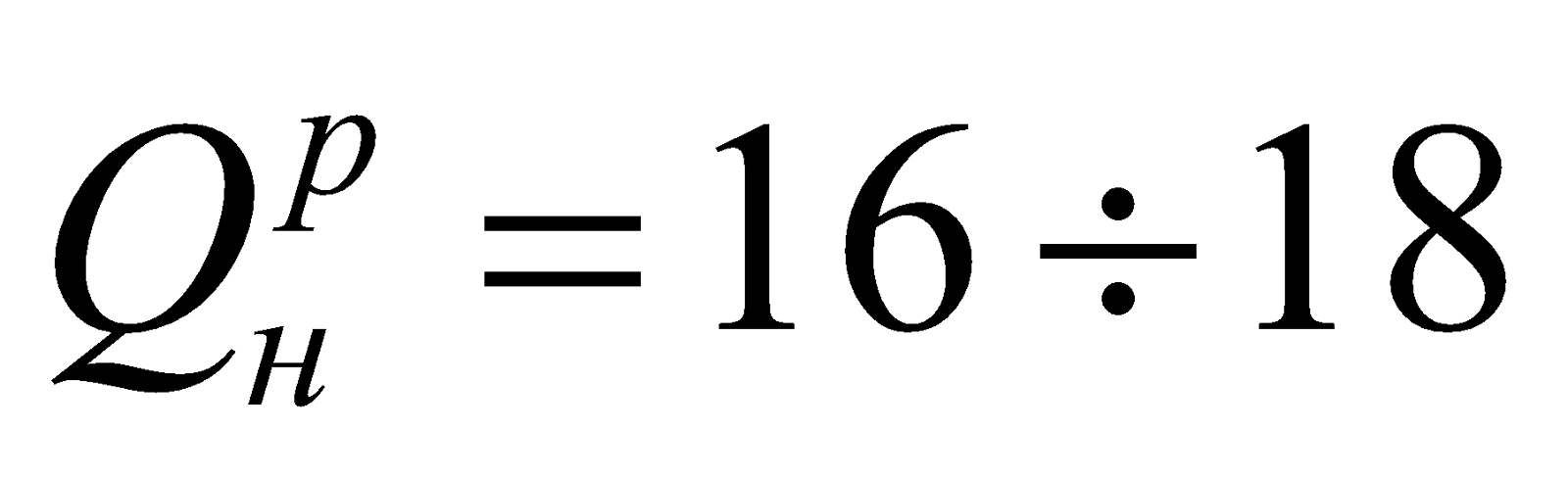 МДж/м3;
МДж/м3;
-
доменный (колошниковый) газ получают в процессе доменной плавки, содержит около 30% СО; МДж/м3.
Жидкое топливо.
Естественное жидкое топливо – нефть. Как топливо ее используют редко.
Искусственное жидкое топливо – это продукты переработки нефти: бензин, лигроин, керосин, газойль и др. Остаток переработки – мазут. Мазут – топливо металлургической промышленности и энергетики. Перед сжиганием мазут нагревают до 70-80оС с целью понижения его вязкости. Состав мазута – это соединения углеродов. С = 85-88%; Н2 = 10%; 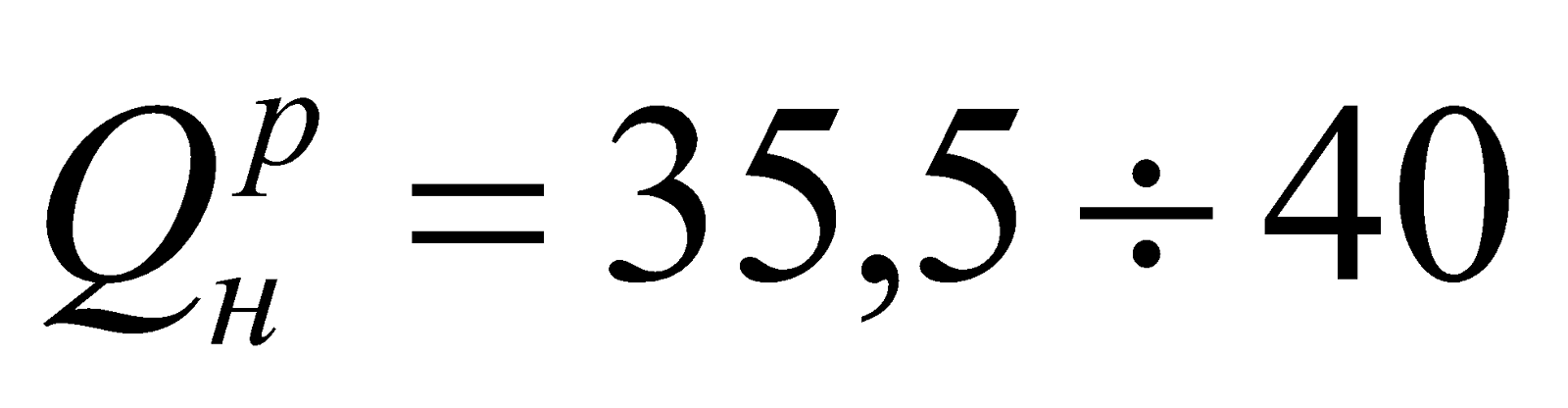 МДж/кг.
МДж/кг.
Твердое топливо.
Это каменный и бурый угли, антрацит, горючие сланцы, торф.
Основной метод переработки угля – коксование, заключающийся в сухой перегонке топлива путем нагрева угля без доступа воздуха при температурах 900-1100оС в коксовых печах. Получается спекшийся кокс, пористый, механически прочный, применяемый в металлургии, в основном для выплавки чугуна. Содержание С=75-85%; 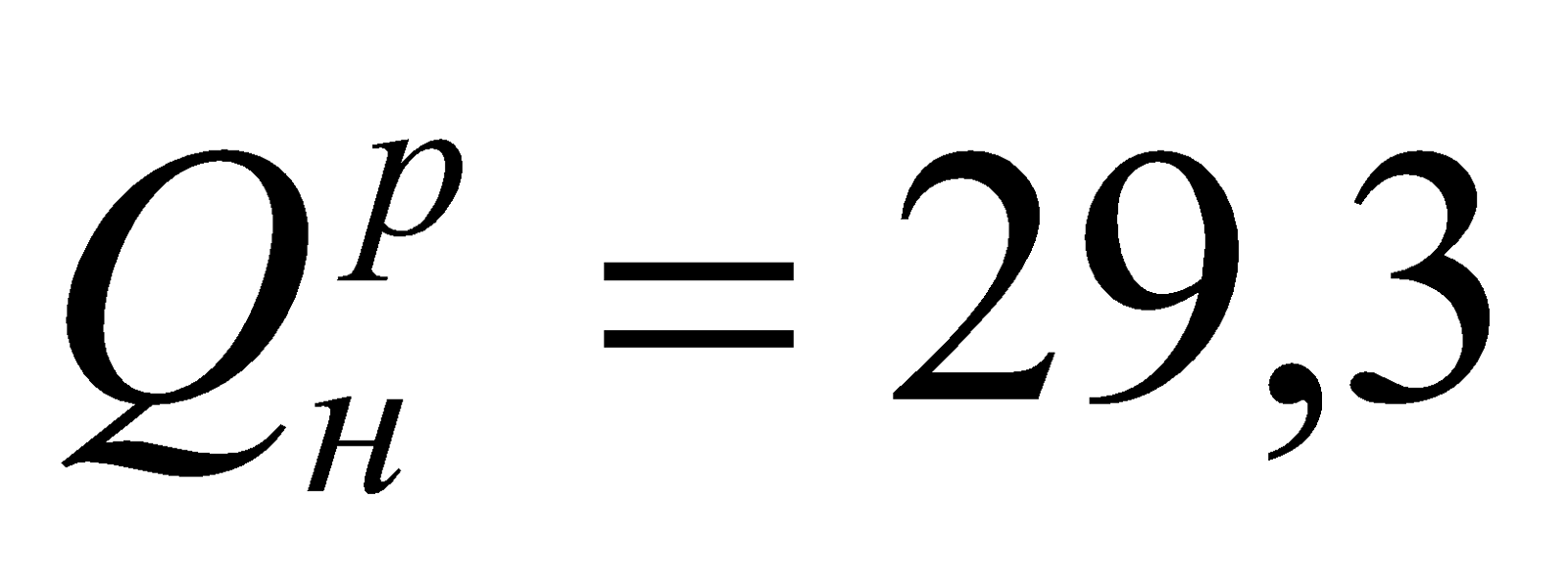 МДж/кг.
МДж/кг.
Ватт и киловатт – что это такое
Ватт – это единица измерения мощности, а также потока тепла в физике, потока звукового электричества, мощности постоянного электрического тока, активной и полной мощности электрического тока, потока излучения и потока энергии ионизирующего излучения в международной системе измерения. Следует отметить, что это скалярная измеримая величина, то есть измеряемая и вычисляемая.

Описание из ссылки
Чтобы сделать использование ватт удобным, международная система приняла использование префиксов, которые определяют десятичное число, кратное исходному индикатору. Обычно для этого используется один киловатт. В переводе с греческого приставка килограмм означает тысячу. Использование префикса означает увеличение исходной стоимости в 103 раза.
Примечание! КВт в час – это несистемная единица измерения, которая показывает, когда энергия производится или потребляется и в каком количестве. Он также показывает выполненную механическую работу и температуру. Используется для измерения потребления электроэнергии в домашних хозяйствах или для измерения производства электроэнергии в энергетическом секторе.
Удельная теплота сгорания газообразного топлива и горючих газов
Представлена таблица удельной теплоты сгорания газообразного топлива и некоторых других горючих газов в размерности МДж/кг. Из рассмотренных газов наибольшей массовой удельной теплотой сгорания отличается водород. При полном сгорании одного килограмма этого газа выделится 119,83 МДж тепла. Также высокой теплотворной способностью обладает такое топливо, как природный газ — удельная теплота сгорания природного газа равна 41…49 МДж/кг (у чистого метана 50 МДж/кг).
| Топливо | Удельная теплота сгорания, МДж/кг |
|---|---|
| 1-Бутен | 45,3 |
| Аммиак | 18,6 |
| Ацетилен | 48,3 |
| Водород | 119,83 |
| Водород, смесь с метаном (50% H2 и 50% CH4 по массе) | 85 |
| Водород, смесь с метаном и оксидом углерода (33-33-33% по массе) | 60 |
| Водород, смесь с оксидом углерода (50% H2 50% CO2 по массе) | 65 |
| Газ доменных печей | 3 |
| Газ коксовых печей | 38,5 |
| Газ сжиженный углеводородный СУГ (пропан-бутан) | 43,8 |
| Изобутан | 45,6 |
| Метан | 50 |
| н-Бутан | 45,7 |
| н-Гексан | 45,1 |
| н-Пентан | 45,4 |
| Попутный газ | 40,6…43 |
| Природный газ | 41…49 |
| Пропадиен | 46,3 |
| Пропан | 46,3 |
| Пропилен | 45,8 |
| Пропилен, смесь с водородом и окисью углерода (90%-9%-1% по массе) | 52 |
| Этан | 47,5 |
| Этилен | 47,2 |
Закон Джоуля-Ленца: задачи с решением
Для решения любой физической задачи существует алгоритм: сначала записываются все известные данные, затем определяются величины, которые нужно найти. Подробнее о решении физических задач читайте в нашей памятке для студентов. Также советуем держать под рукой формулы, это существенно облегчит процесс решения.
Кстати, если вы интересуетесь задачами на закон Джоуля-Ленца, вам также может быть полезно ознакомиться с задачами на мощность тока.
Задача на закон Джоуля-Ленца №1
Условие
Какое количество теплоты выделяет за 5 минут нагреватель электрочайника, если его сопротивление равно 30 Ом, а сила тока в цепи 1,5 А?
Решение
Это простейшая задача на закон Джоуля-Ленца для участка цепи. Запишем сам закон:
Q=I2Rt
Подставив значения из условия в формулу, найдем:
Q=1,52·30·300=20250 Дж
Ответ: 20,25 кДж.
Задача на закон Джоуля-Ленца №2
Условие
Какое количество теплоты выделит за 40 минут спираль электроплитки, если сила тока в цепи 3 А, а напряжение 220 В?
Решение
Эта также простейшая задача на закон Джоуля-Ленца, но, в отличие от первой задачи, при ее решении используется другая формулировка закона. Сначала запишем закон Джоуля-Ленца:
Q=I2Rt
Теперь перепишем его с учетом закона Ома:
I=URR=UIQ=I2UIt=IUt
Осталось подставить значения и вычислить:
Q=3·220·2400=1,584 МДж
Ответ: 1,584 МДж.
Задача на закон Джоуля-Ленца №3
Условие
Сколько минут ток шел по проводнику сопротивлением 25 Ом, если при силе тока 1 А проводник вылелил 6 кДж теплоты.
Решение
Запишем закон Джоуля-Ленца и выразим время:
Q=I2Rtt=QI2R
Найдем:
t=600012·25=240 c=4 мин
Ответ: 4 минуты.
При расчетах не забывайте переводить все величины из условия в систему СИ.
Задача на закон Джоуля-Ленца №4
Условие
Электрическая плитка при силе тока 4 А за 20 минут потребляет 1000 кДж энергии. Рассчитайте сопротивление плитки.
Решение
Выразим сопротивление из закона Джоуля-Ленца:
Q=I2RtR=QI2t
Подставим значения и вычислим:
R=1000·10316·1200=52 Ом
Ответ: 52 Ом.
Задача на закон Джоуля-Ленца №5
Условие
По проводнику с сопротивлением 6 Ом пропускали постоянный ток в течение 9 c. Какое количество теплоты выделилось в проводнике за это время, если через его сечение прошел заряд 3 Кл?
Решение
Заряд можно определить, зная время и силу тока. А зная заряд и врямя, за которое он прошел по проводнику, найдем силу тока:
I=qt
Запишем закон Джоуля-Ленца для количества теплоты:
Q=I2RtQ=q2t2Rt=q2Rt
Подставим значения и вычислим:
Q=32·69=6 Дж
Ответ: 6 Дж.
Расчет горения смеси природного и доменного газов.
Исходные данные для расчета
-
Состав сухого природного и доменного газов, %
|
Газ |
CO |
CO2 |
CH4 |
C2H6 |
C3H8 |
C4H10 |
C5H12 |
H2 |
N2 |
O2 |
∑ |
|
Природный |
— |
0,5 |
85,0 |
4,0 |
2,5 |
1,5 |
1,5 |
— |
5,0 |
— |
100 |
|
Доменный |
27 |
12,7 |
0,3 |
— |
— |
— |
— |
1,4 |
58,6 |
— |
100 |
-
Коэффициент расхода воздуха: n = 1,14;
-
Содержание влаги в доменном газе: Wд.г. = 44г/м3;
-
Содержание влаги в природном газе: Wп.г. = 0г/м3 (газ сухой);
-
Теплота сгорания смеси: ;
-
Температура подогрева воздуха и газа: tВ = 600оС = 873К;
tГ = 400оС = 673К;
-
Температура уходящих продуктов сгорания (дыма): tП.Г. = 840оС = 1113К;
-
Расчет ведется на 1м3 газа.
Расчет состава природно-доменной смеси.
1. Пересчет состава сухого доменного газа на влажный.
Объемный процент водяных паров во влажном доменном газе:
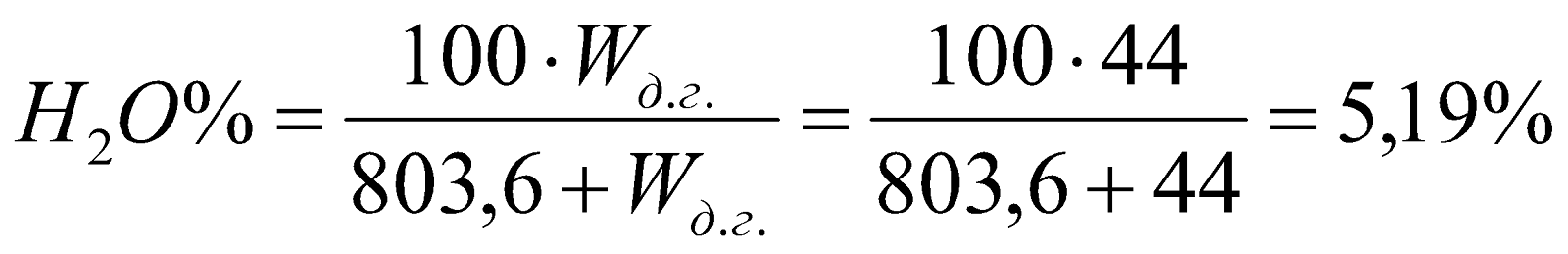 .
.
Коэффициент пересчета состава сухого доменного газа во влажный (рабочий):
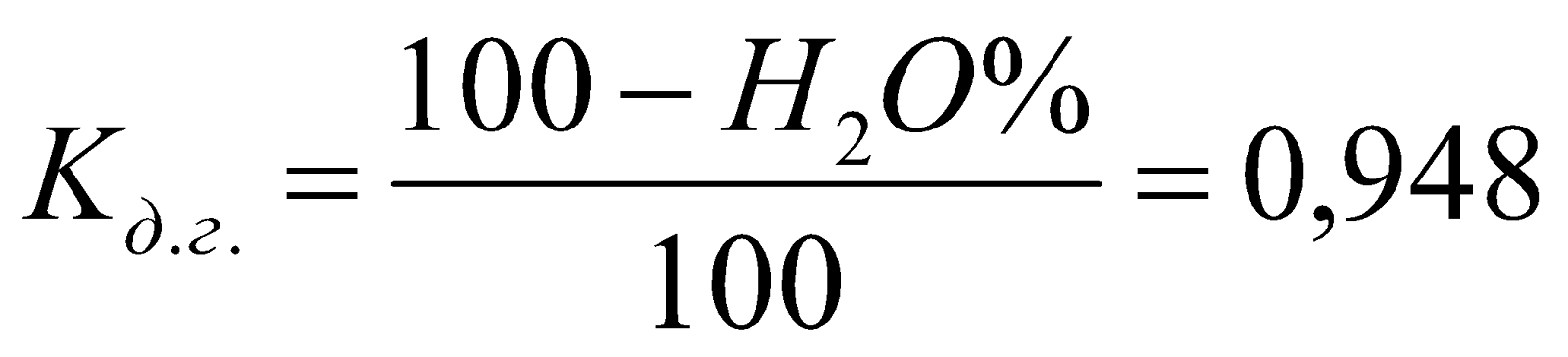 .
.
Рабочий состав доменного газа:
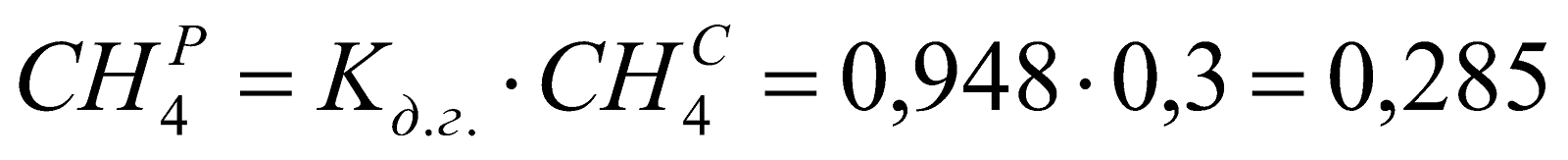 ;
;
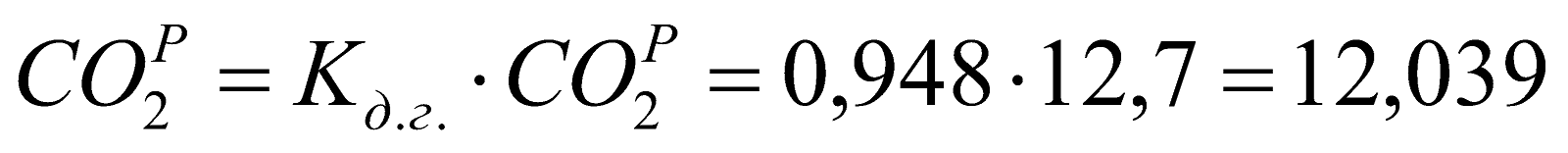 ;
;
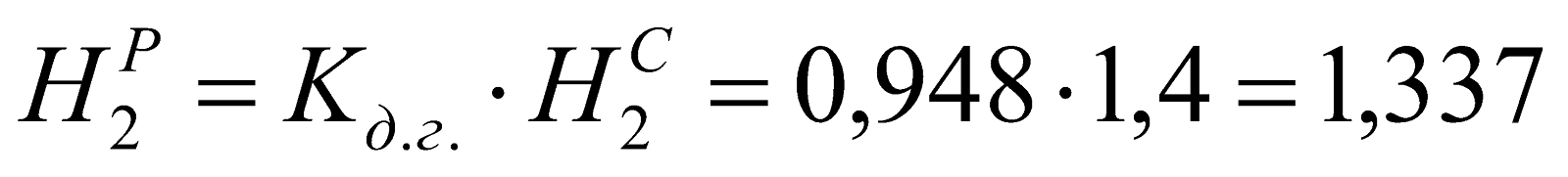 ;
;
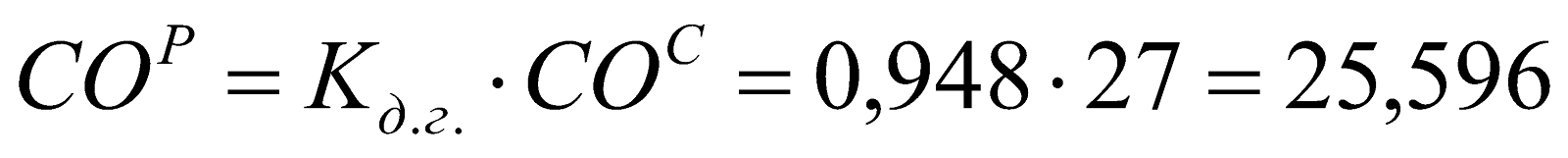 ;
;
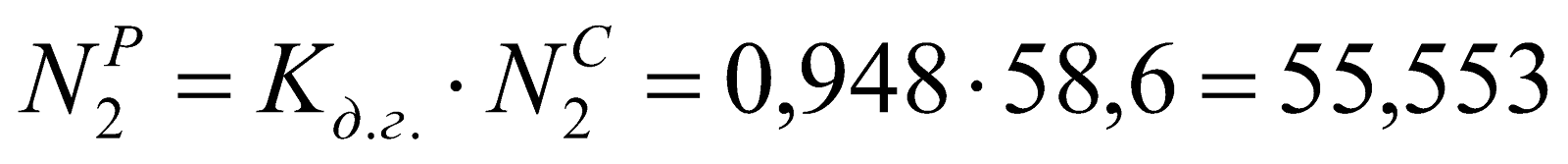 .
.
Таблица 1. Состав рабочего доменного газа.
|
Газ |
СН4 |
СО2 |
H2 |
CO |
N2 |
H2O |
∑ |
|
Доменный |
0,285 |
12,039 |
1,337 |
25,596 |
55,553 |
5,19 |
100 |
2. Определение теплоты сгорания газов 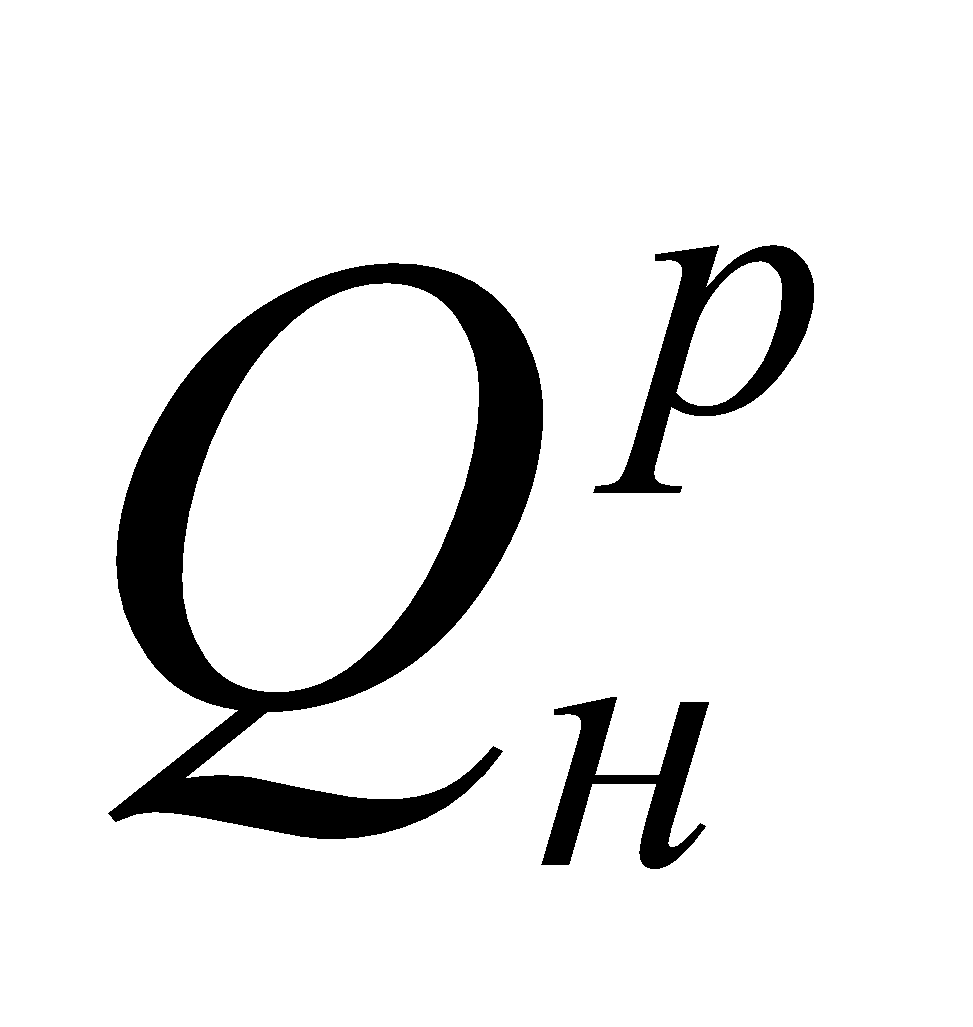 .
.
Природного газа:
![]() .
.
Доменного газа:
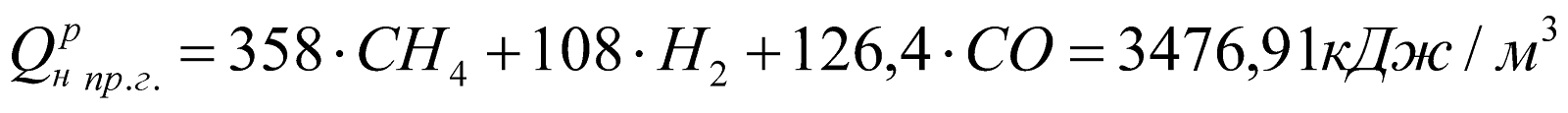 .
.
3. Расчет состава смеси природного и доменного газов.
Принимаем долю доменного газа в природно-доменной смеси (ПДС) за x, тогда доля природного газа будет равна y = (1-x). Составляем уравнение:
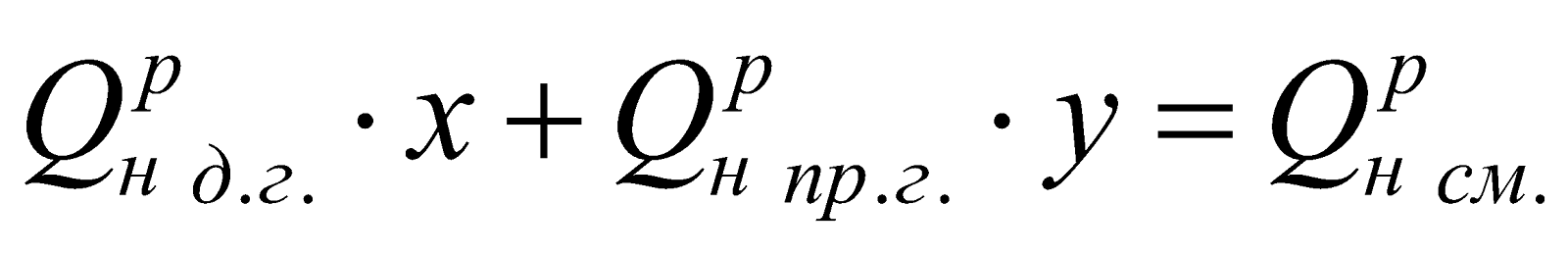 ,
,
где 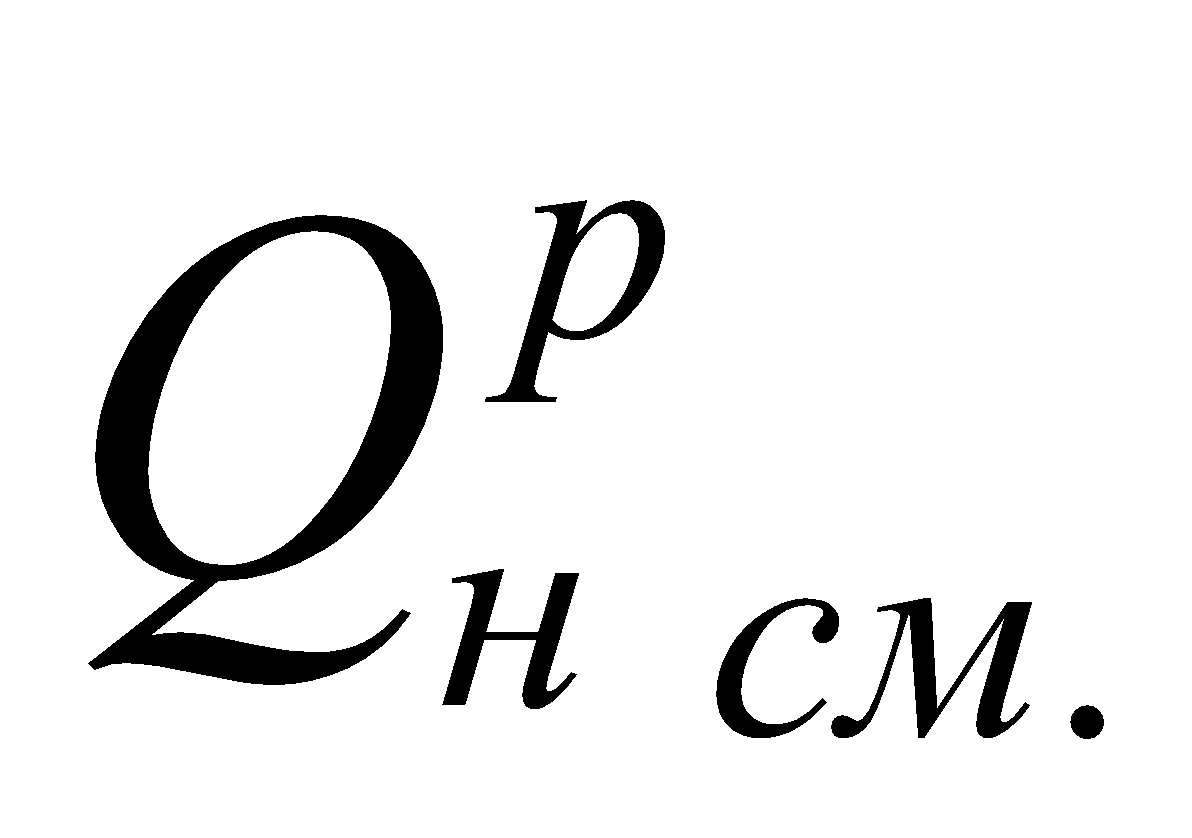 – исходная теплота сгорания смеси газов, МДж/м3.
– исходная теплота сгорания смеси газов, МДж/м3.
Находим, что
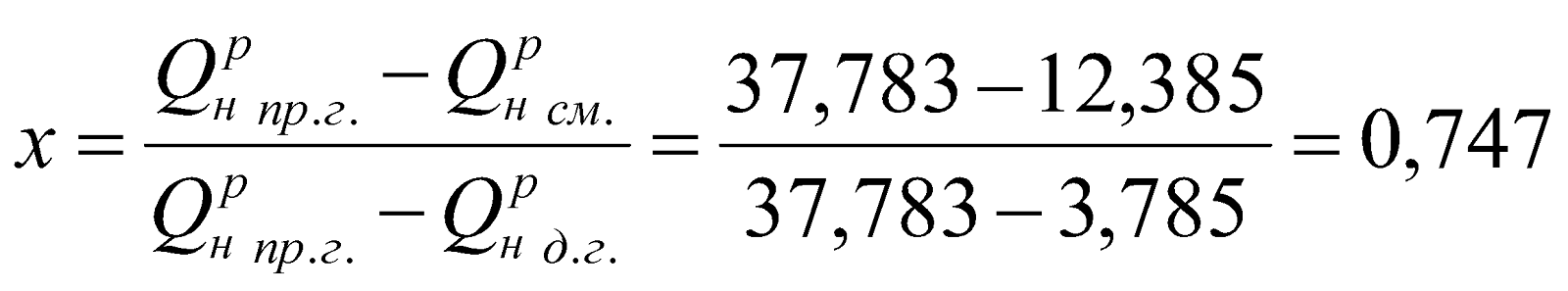 .
.
у = (1-х) = 1-0,747 = 0,253.
Состав смешанного газа, %.
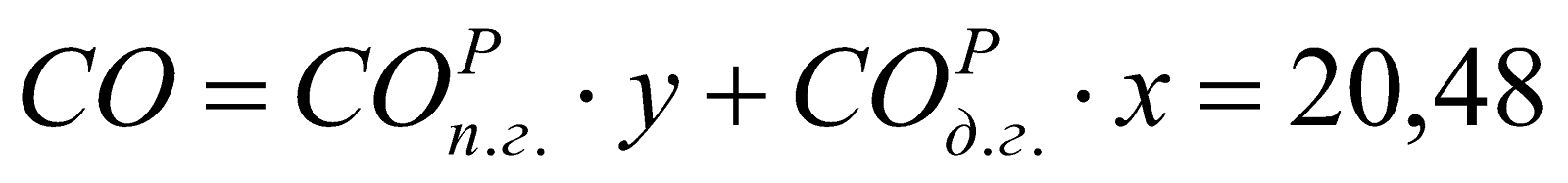 ;
;
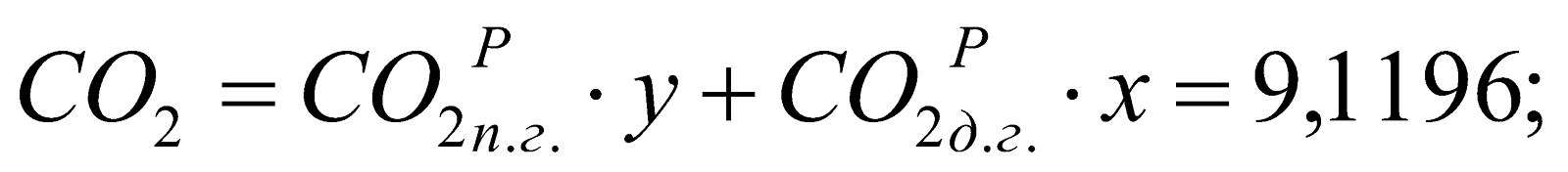
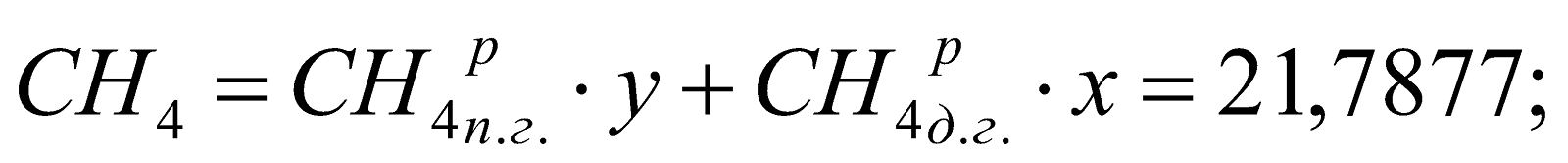
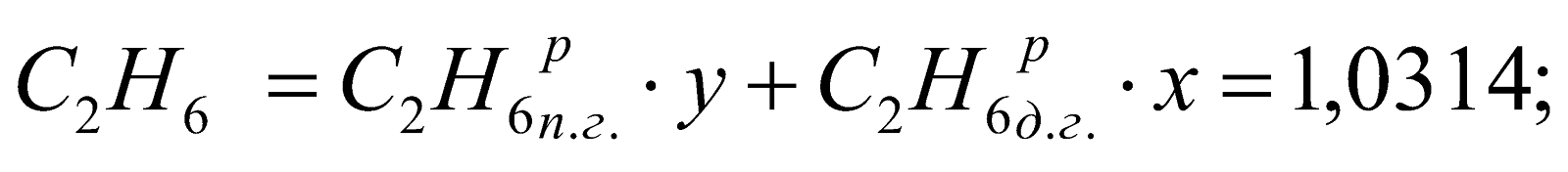
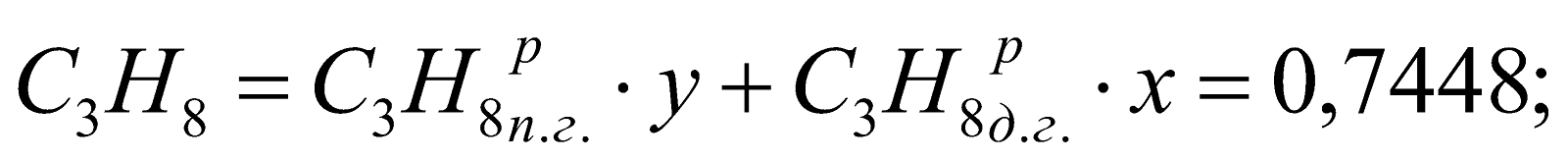
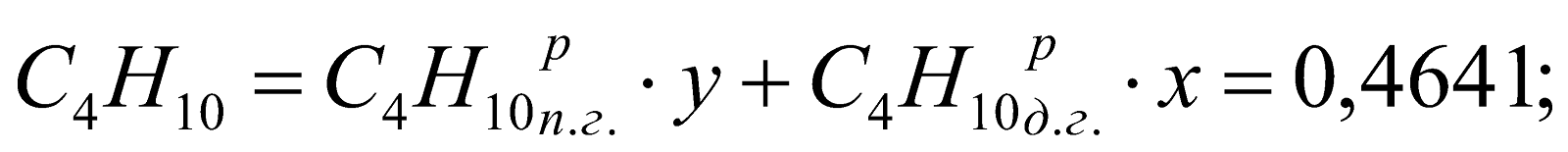
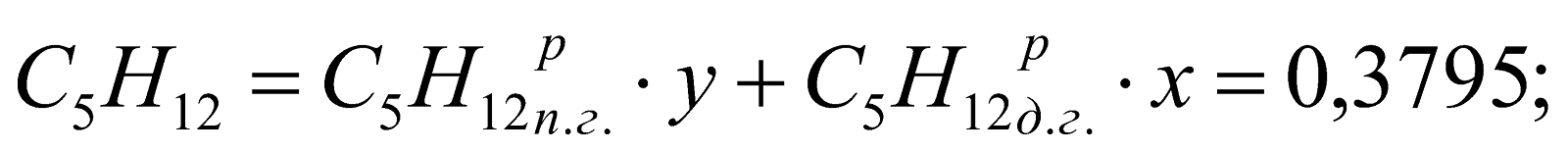
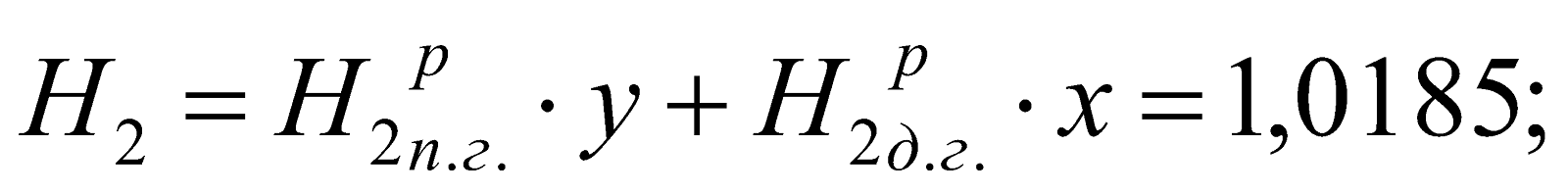
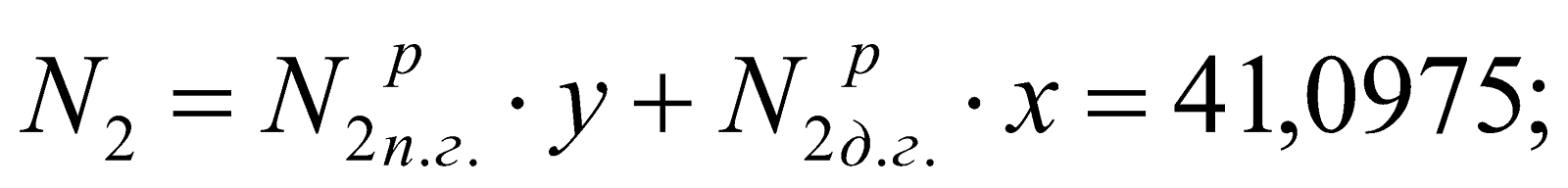
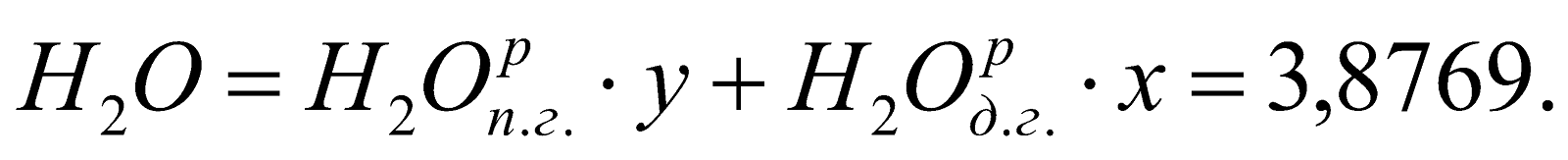
Таблица 2. Состав природно-доменной смеси.
|
CO |
CO2 |
CH4 |
C2H6 |
C3H8 |
C4H10 |
N2 |
H2 |
H2O |
∑ |
|
20,48 |
9,1196 |
21,7877 |
1,0314 |
0,7448 |
0,4641 |
41,0975 |
1,0185 |
3,8769 |
100 |
Проверка:
![]()
Погрешность: 0,004%.
4. Плотность ПДС и воздуха.
Плотность ПДС.
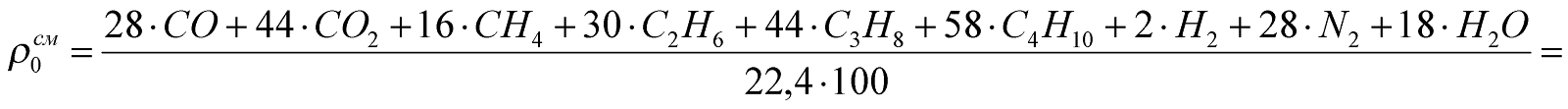
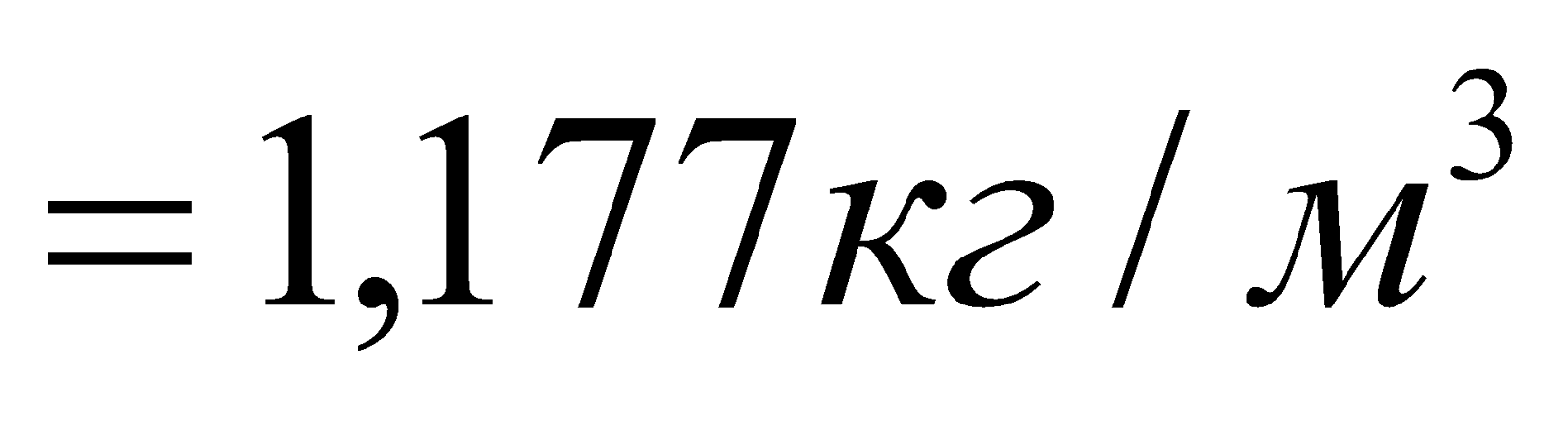 .
.
Плотность воздуха.
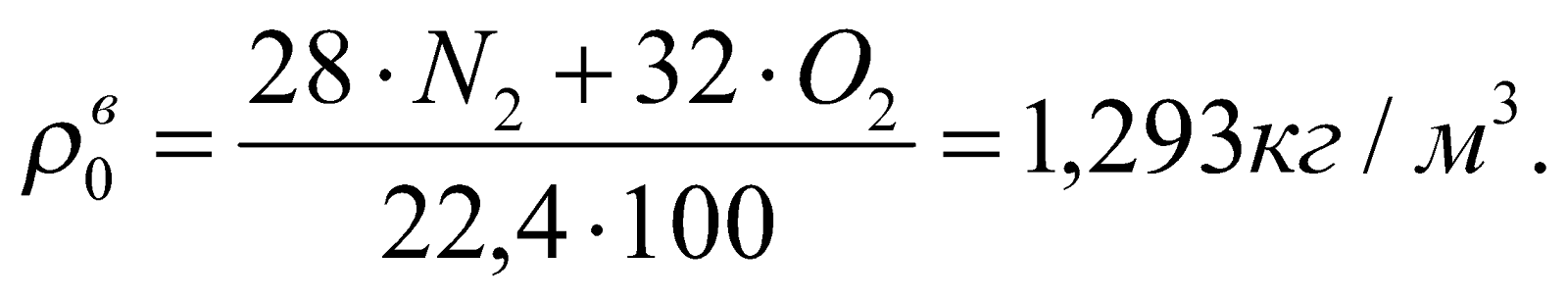
5. Расход воздуха, необходимого для сжигания единицы топлива.
Теоретический расход воздуха (n = 1).
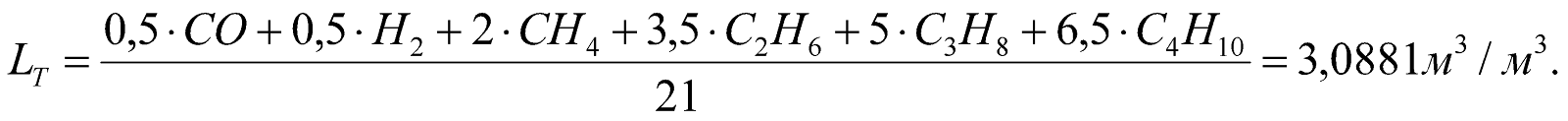
Действительный расход воздуха (n = 1,14).
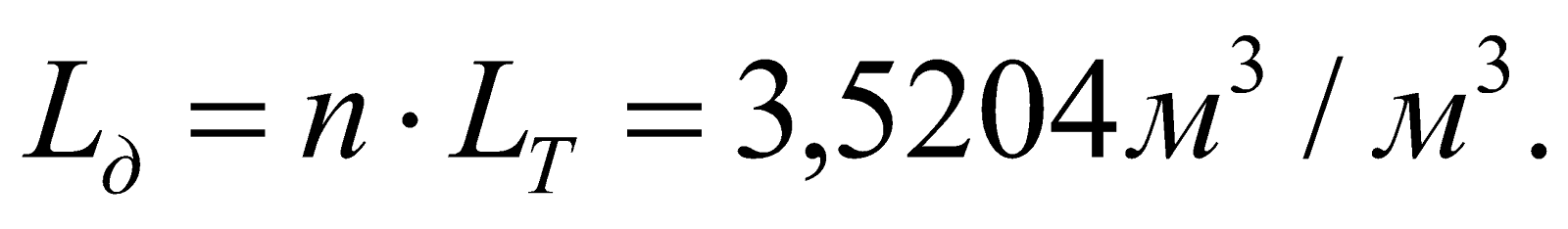
6. Расчет количества и состава продуктов сгорания.
Объем углекислого газа в ПГ:
![]()
Объем водяных паров в ПГ:
![]()
Объем азота в ПГ:
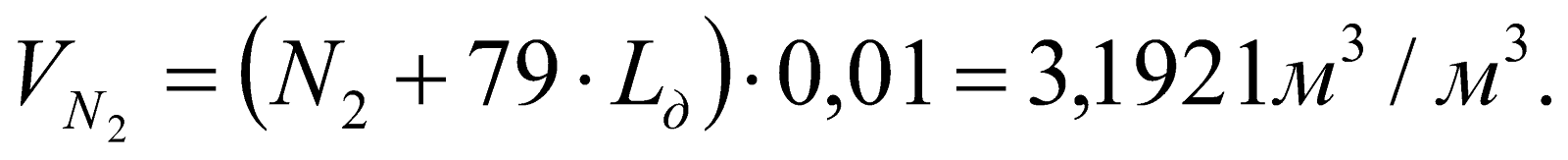
Объем избыточного кислорода в ПГ:
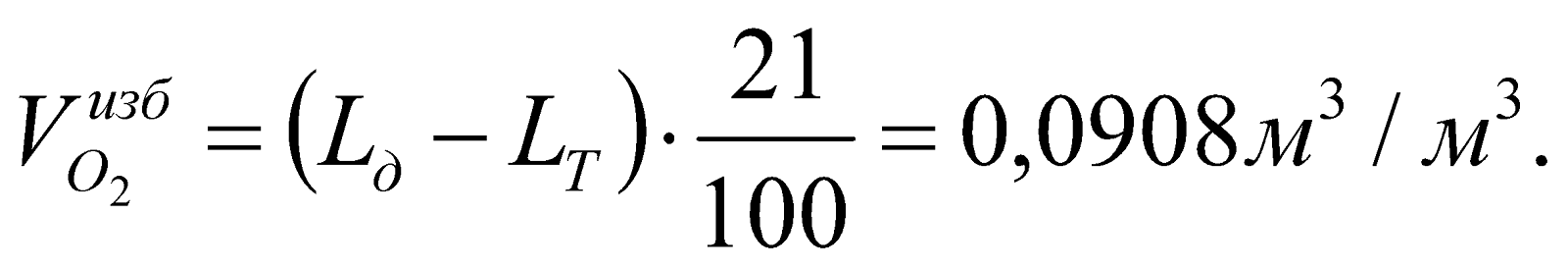
Общее количество ПС:
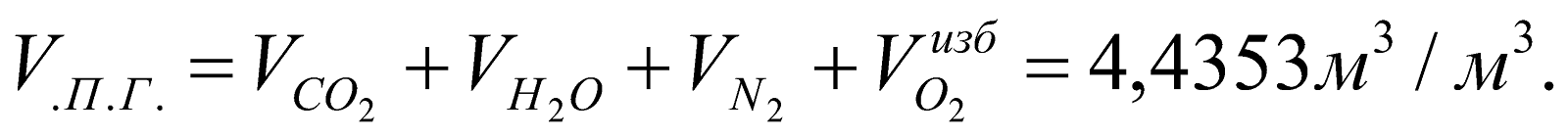
Состав ПС:
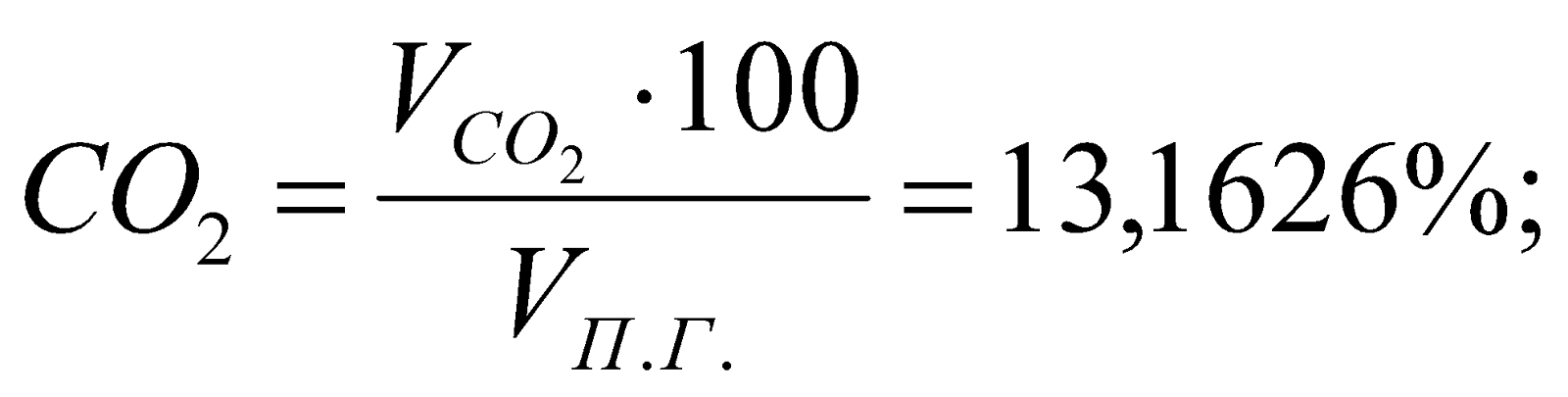
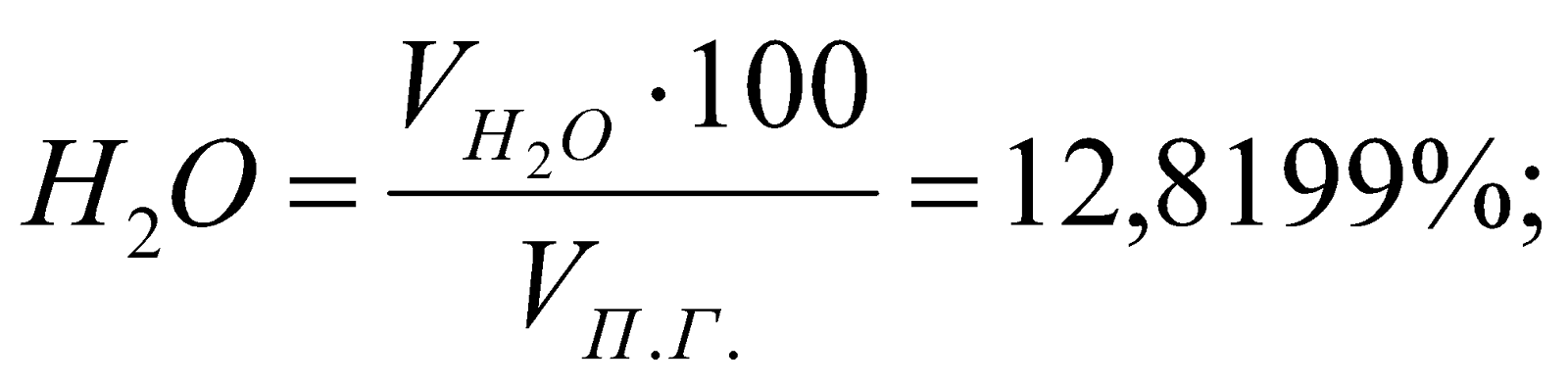
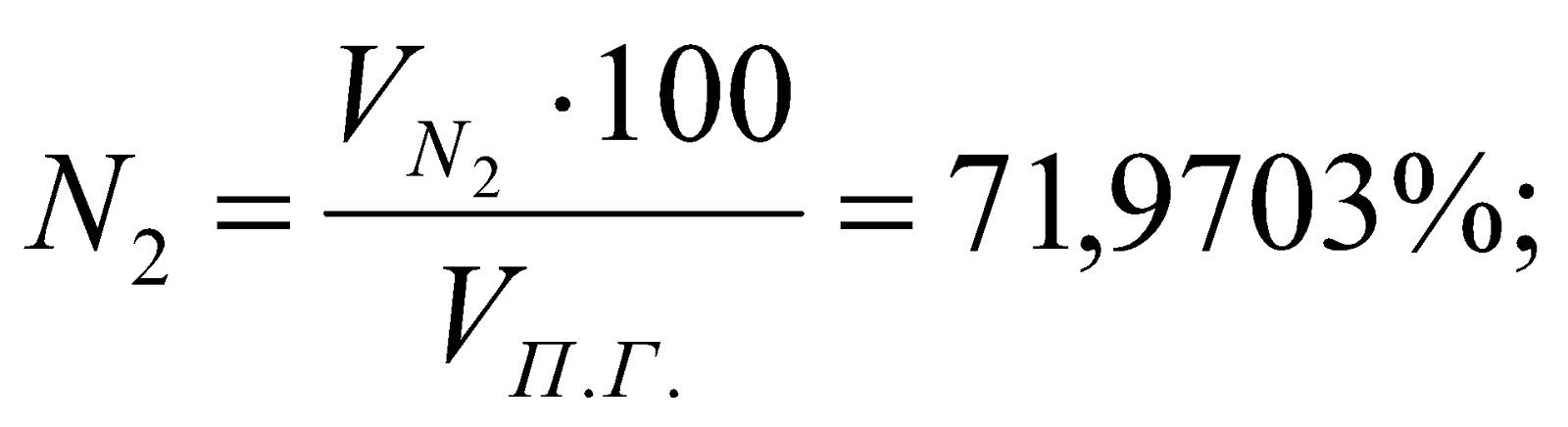
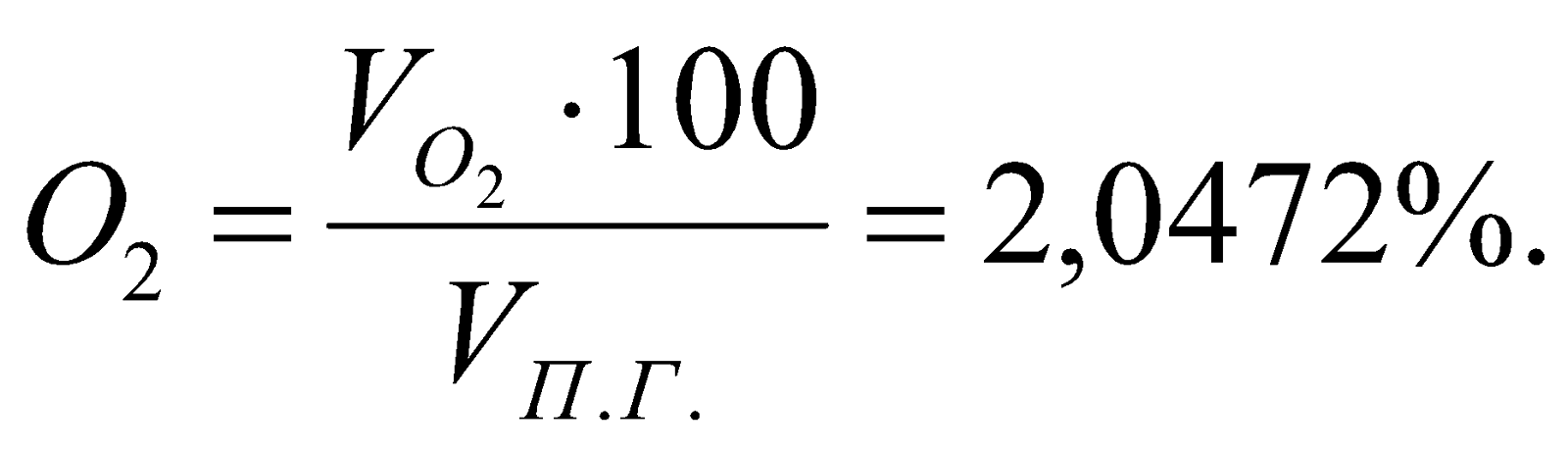
Таблица 3. Состав продуктов сгорания.
|
Продукты сгорания |
СО2 |
Н2О |
N2 |
O2 |
∑ |
|
% |
13,1626 |
12,8199 |
71,9703 |
2,0472 |
100 |
Плотность ПС:
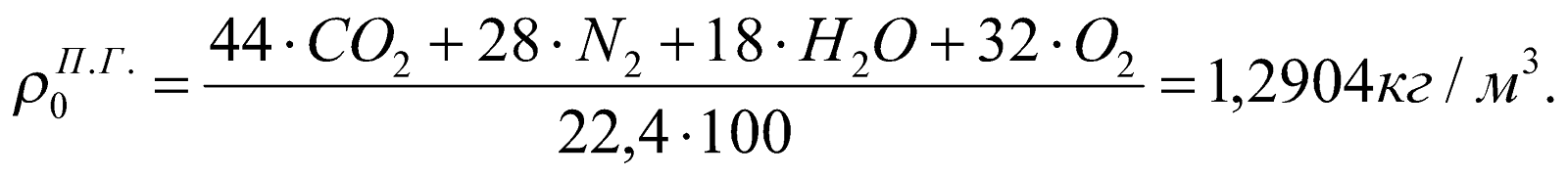
7. Материальный баланс процесса горения.
|
Приход, кг |
Расход, кг |
Невязка баланса, % |
|
1. Газ:
|
Продукты сгорания:
|
|
|
2. Воздух:
|
||
|
Всего: 5,728кг |
5,723кг |
8. Определение калориметрической температуры горения.
Находим начальную энтальпию продуктов сгорания 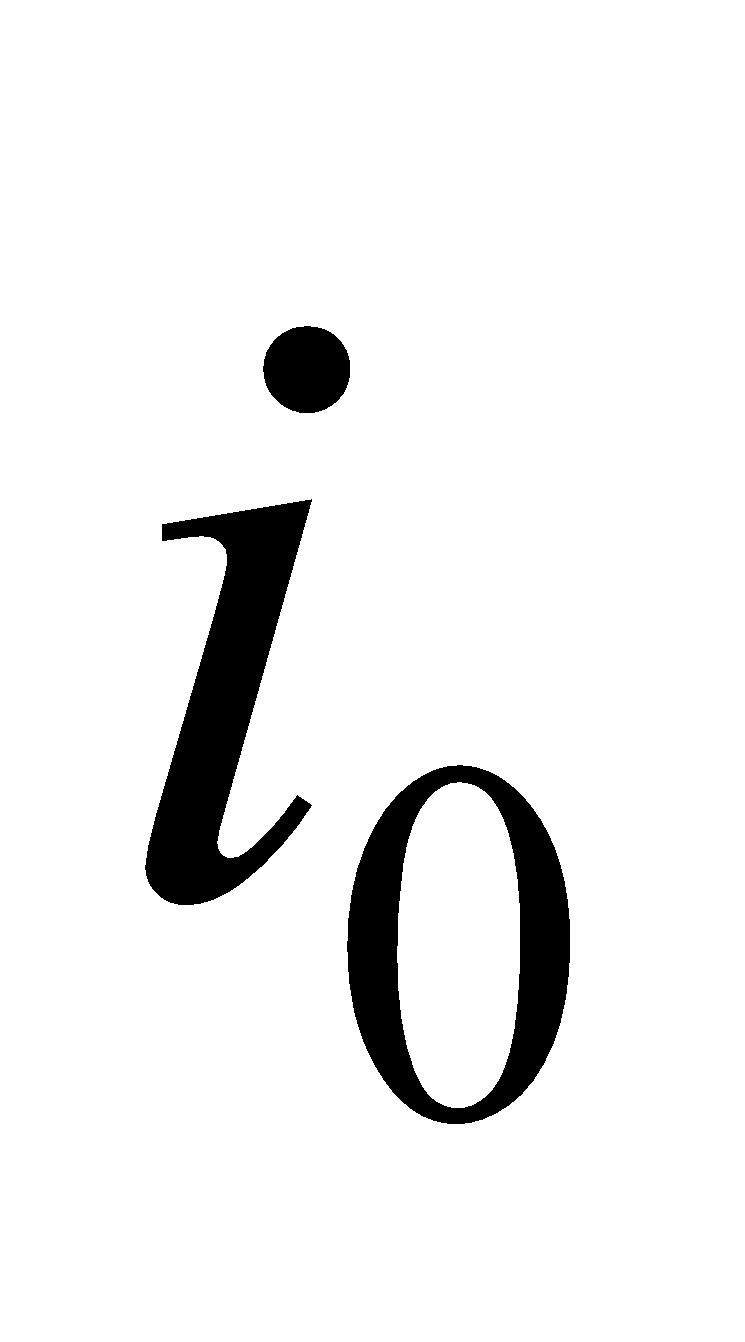 по формуле, где известно физическое тепло подогретого газа и воздуха.
по формуле, где известно физическое тепло подогретого газа и воздуха.
Физическое тепло газа:
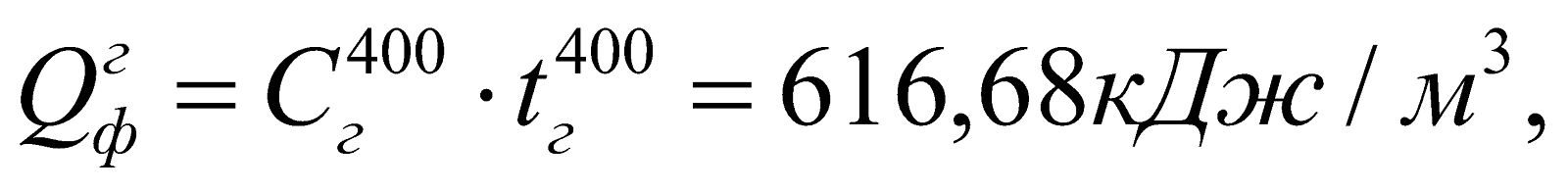
где 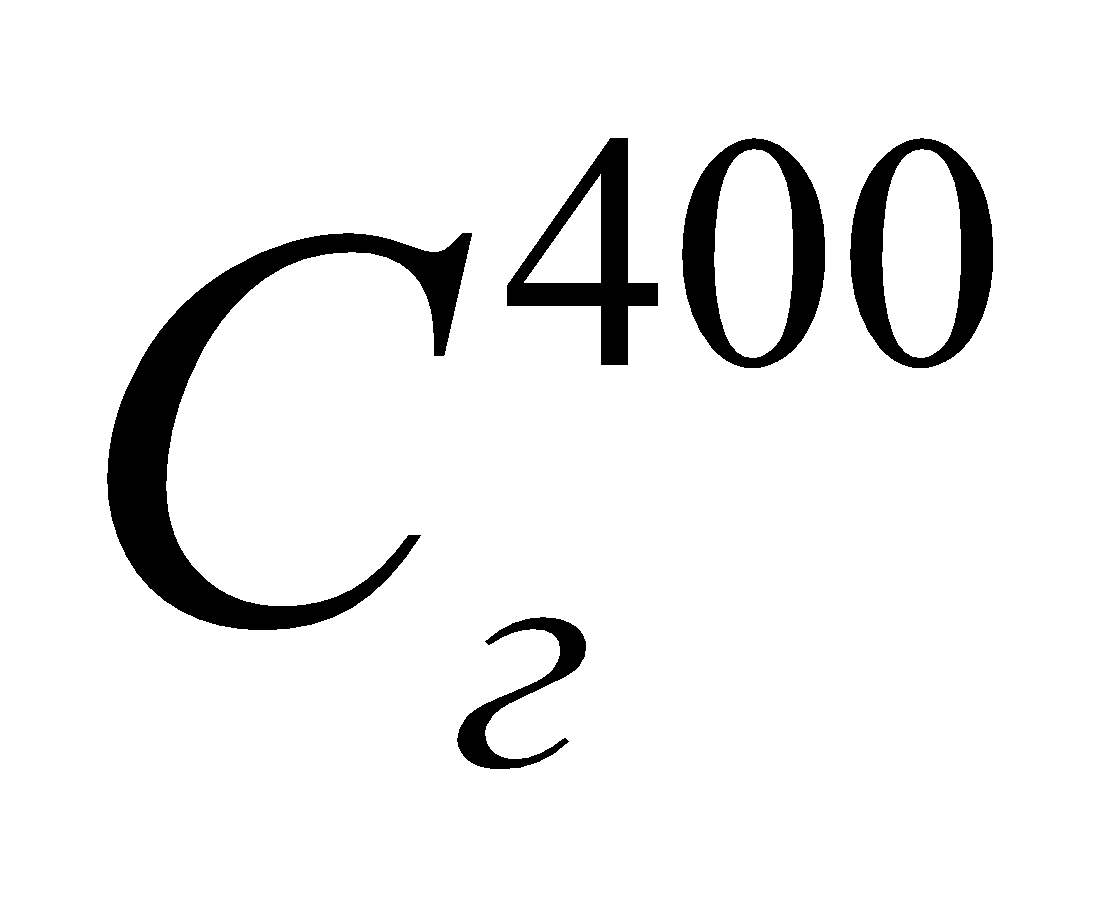 – теплоемкость подогретого газа при t = 400oC, найденная по формуле:
– теплоемкость подогретого газа при t = 400oC, найденная по формуле:
![]()
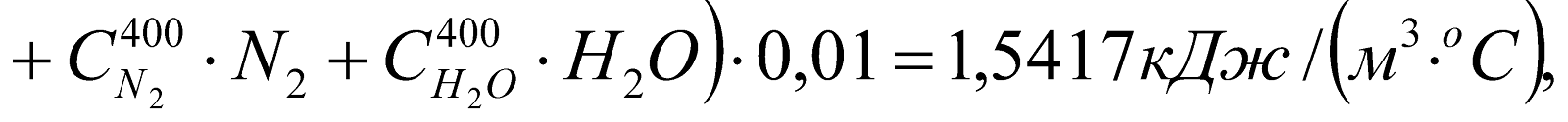
где:
-
теплоемкости , и т.д., а также Св – теплоемкость подогретого воздуха берем из таблицы №4 (Расчет горения газообразного топлива. Методические указания к курсу «Теплотехника», Алматы – 1983г.);
-
теплоемкости для газов метанового ряда берем из таблицы №5 (там же).
Физическое тепло подогретого воздуха:
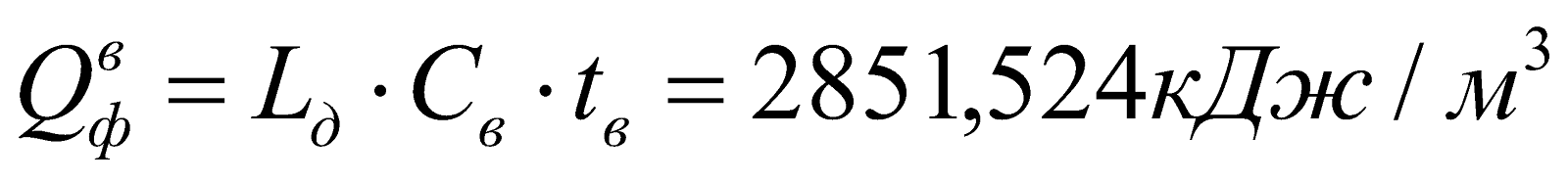 .
.
Начальная энтальпия продуктов сгорания:
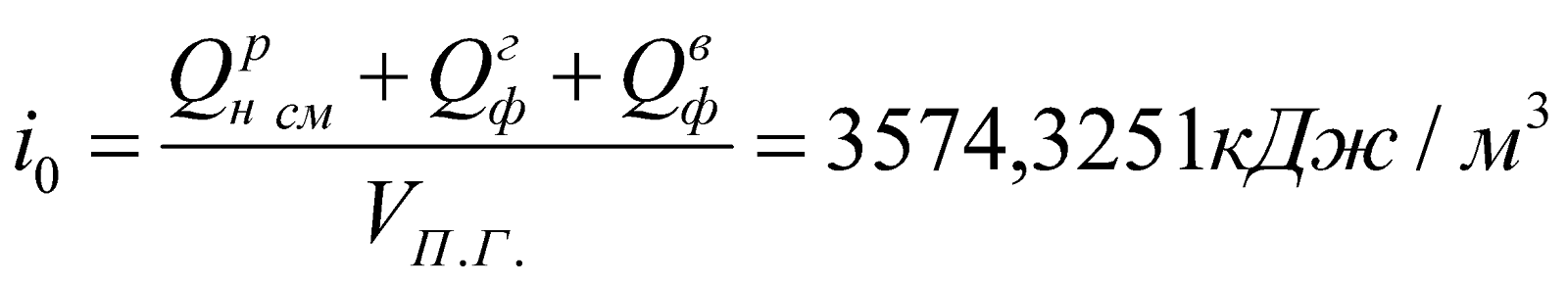 .
.
По величине 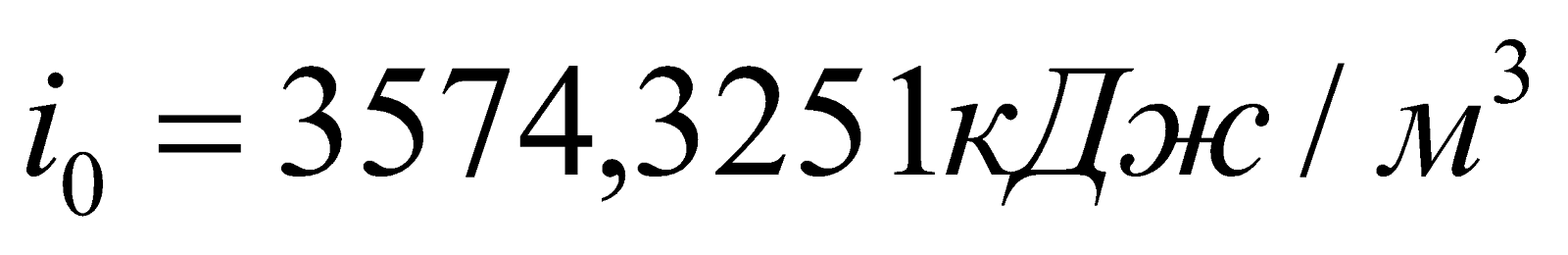 , используя таблицу №7 (там же), находим приближенное значение
, используя таблицу №7 (там же), находим приближенное значение 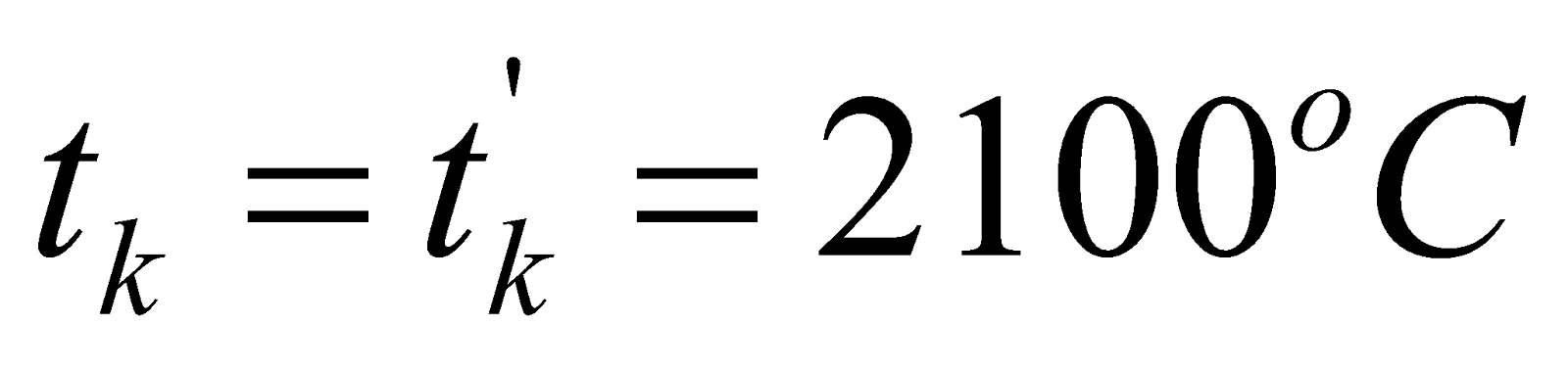 .
.
Определяем энтальпию продуктов горения при этой температуре:
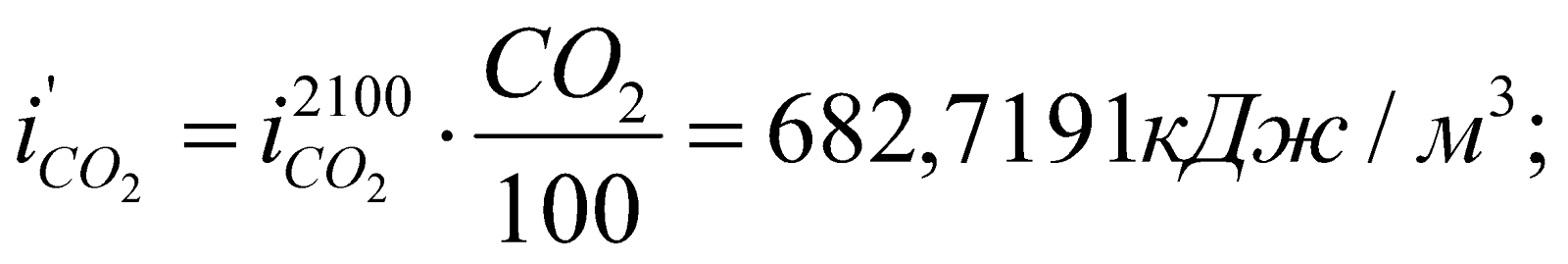
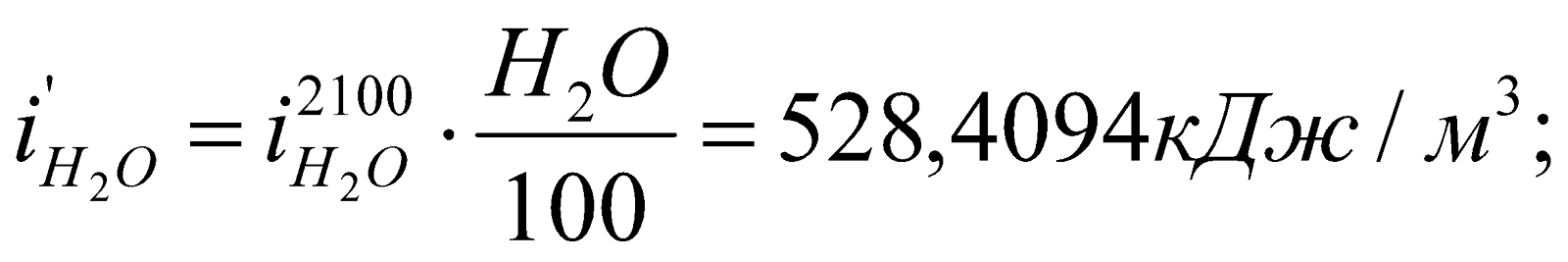
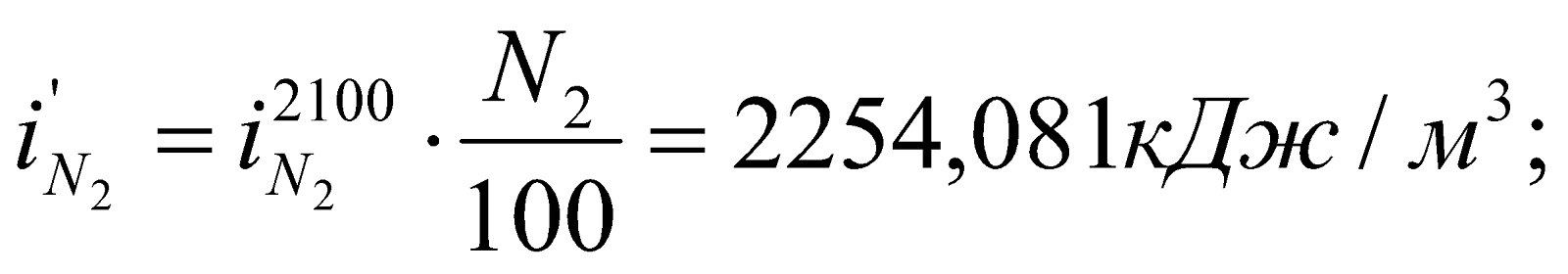
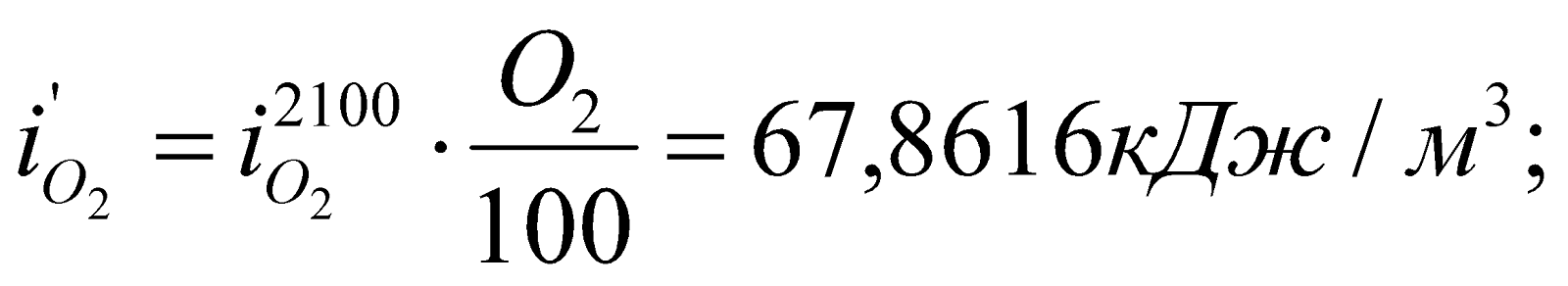
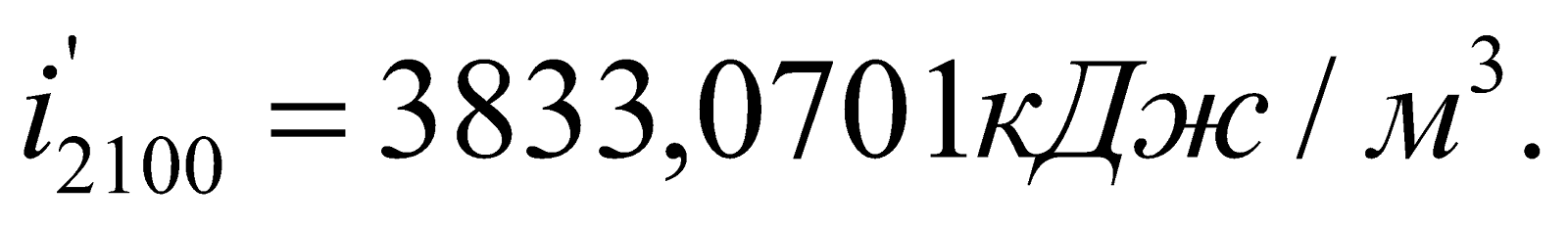
Значения 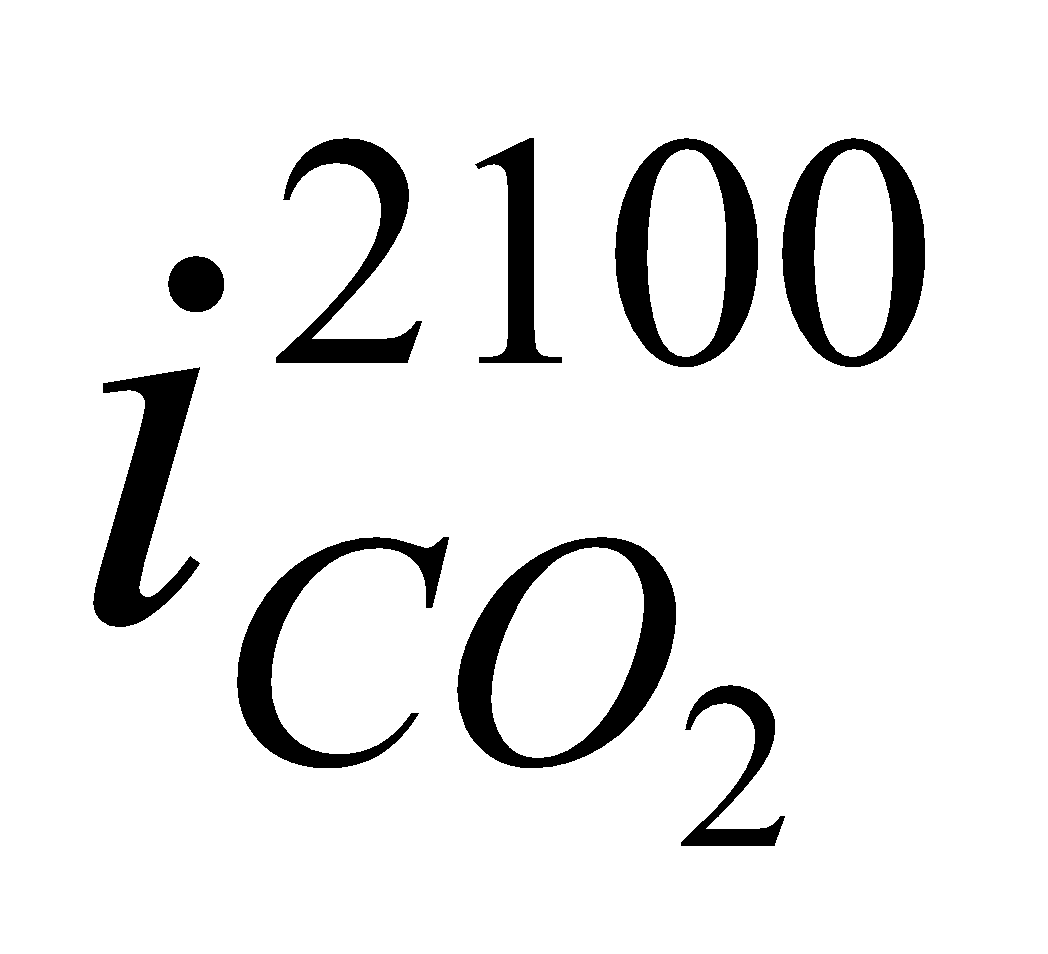 ,
, 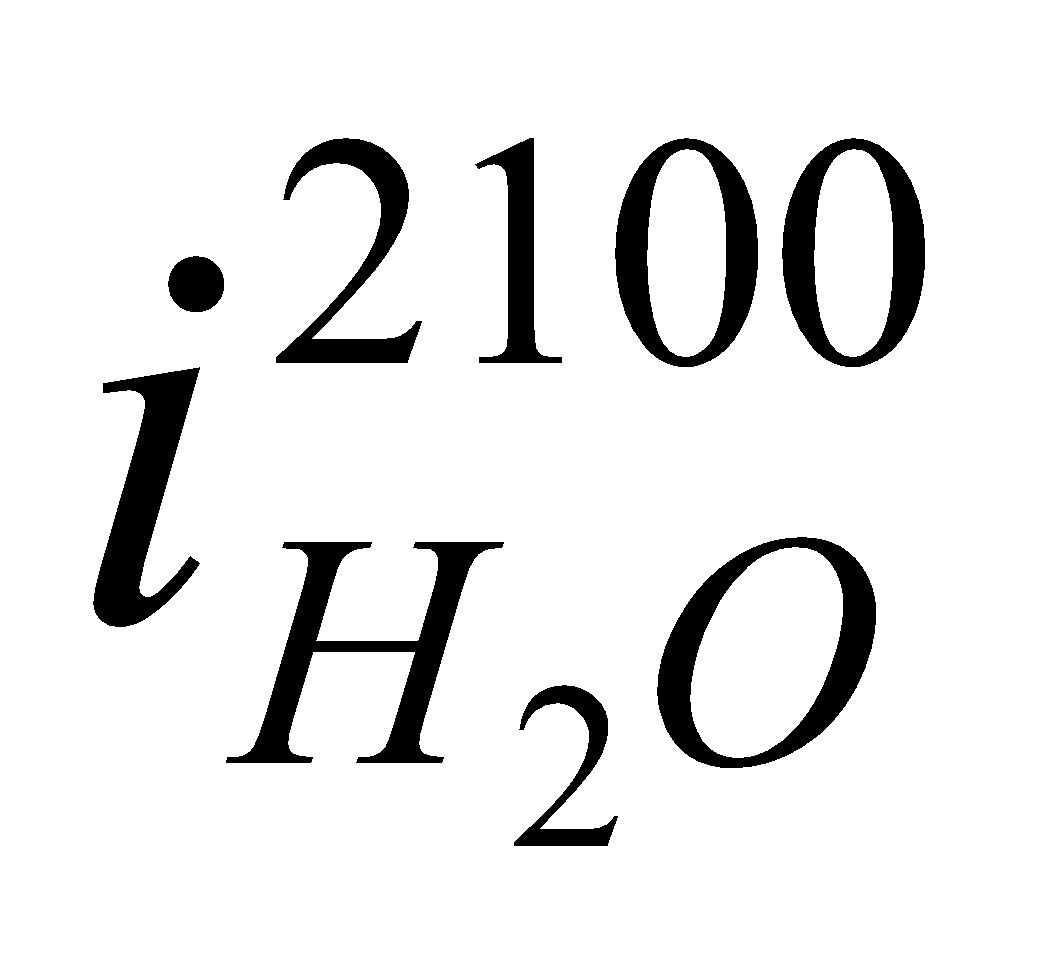 и т.д. находим из таблицы №6 (там же).
и т.д. находим из таблицы №6 (там же).
Полученное значение 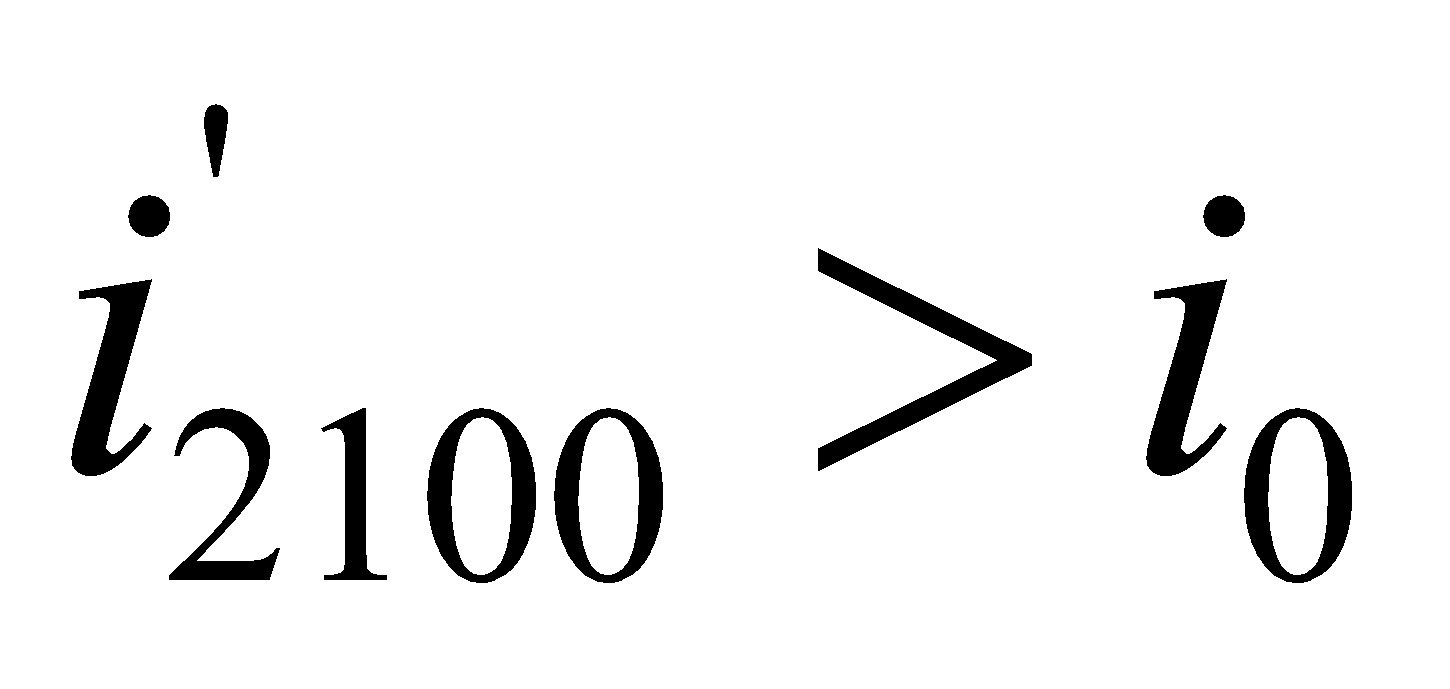 , значит,
, значит, 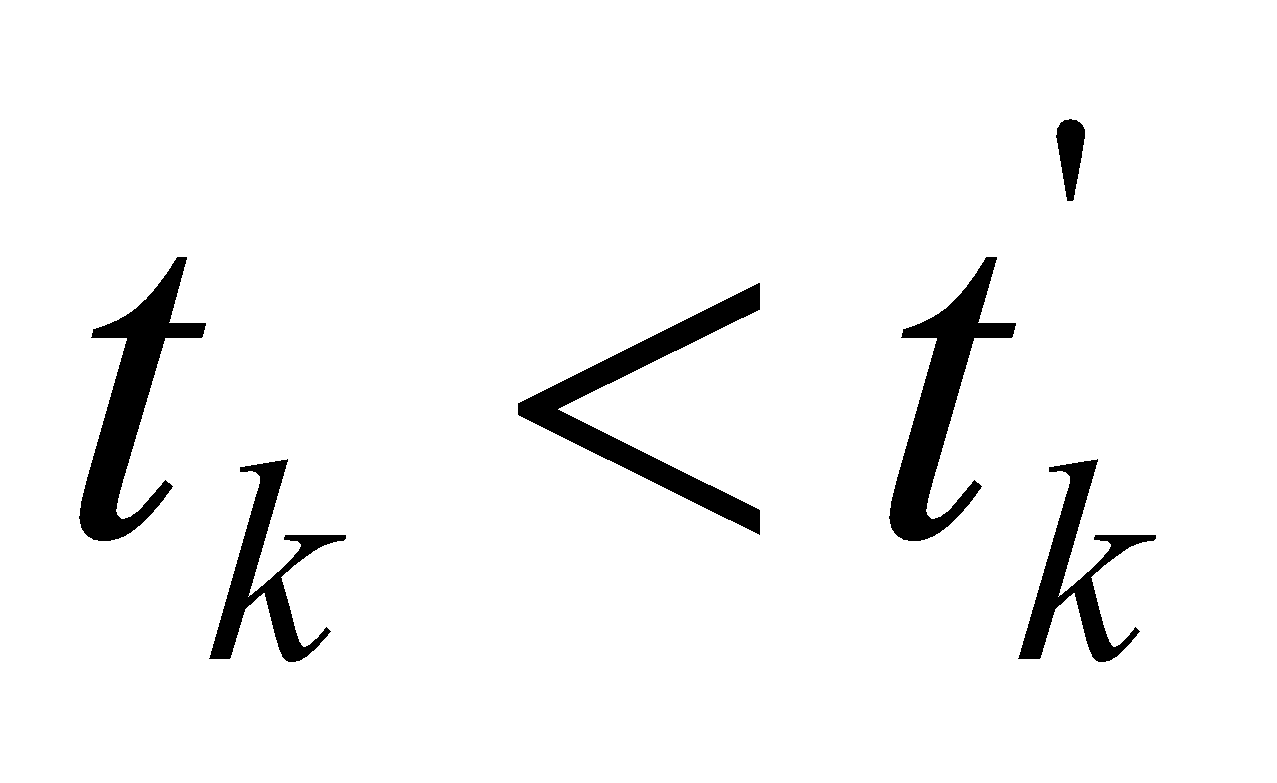 .
.
Находим 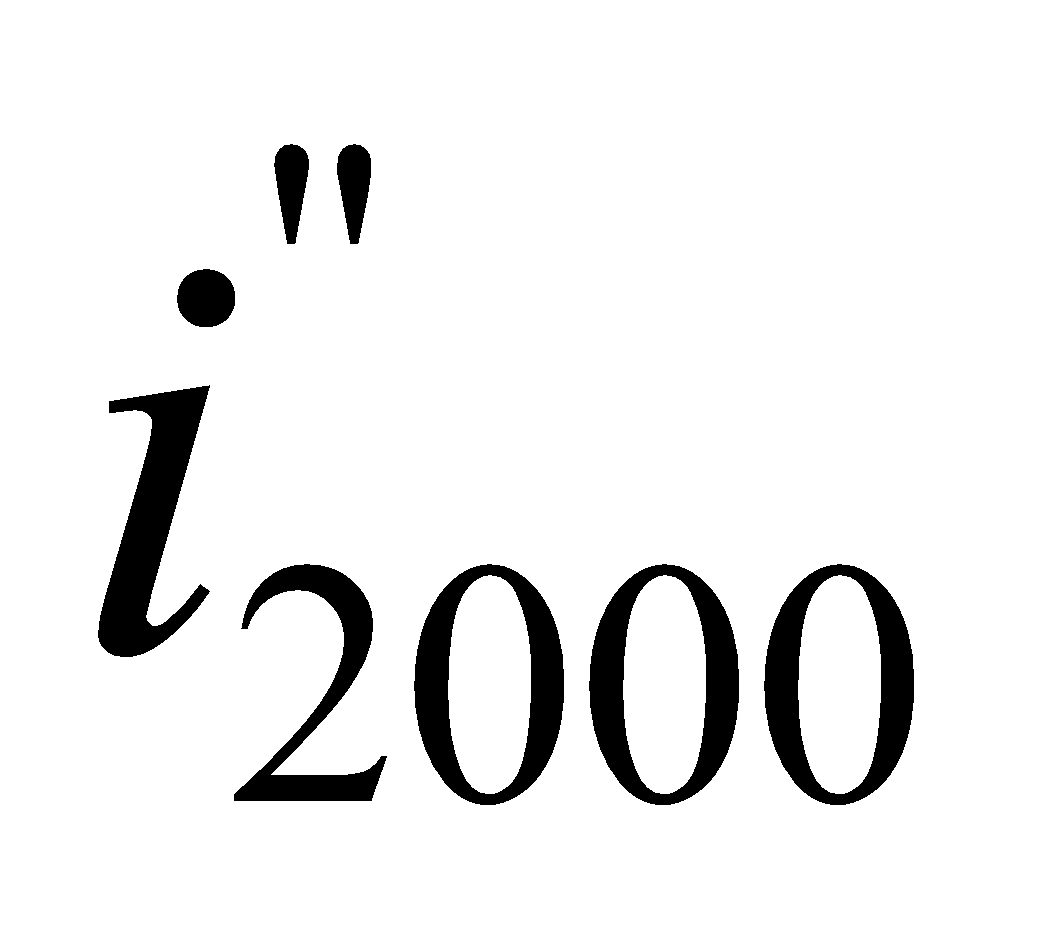 – энтальпию продуктов сгорания при 2000оС:
– энтальпию продуктов сгорания при 2000оС:
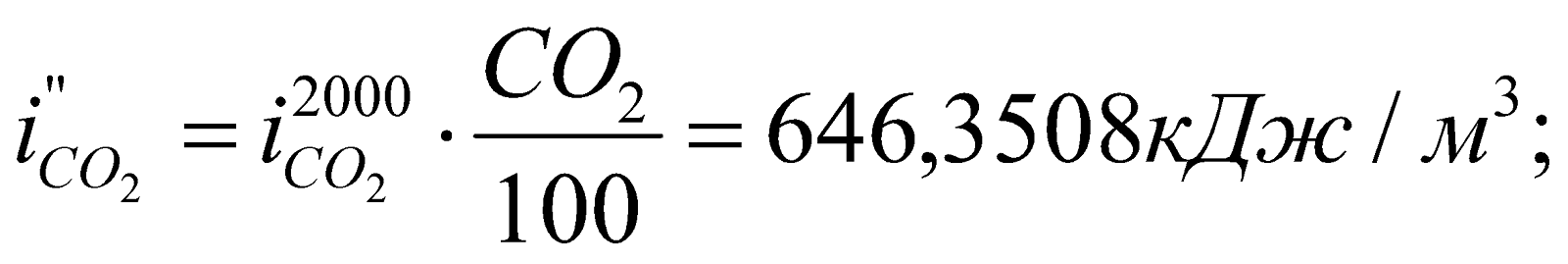
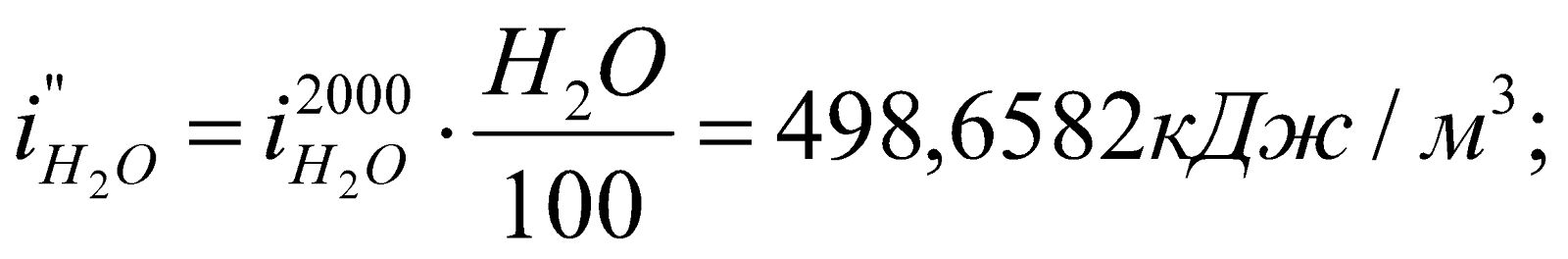
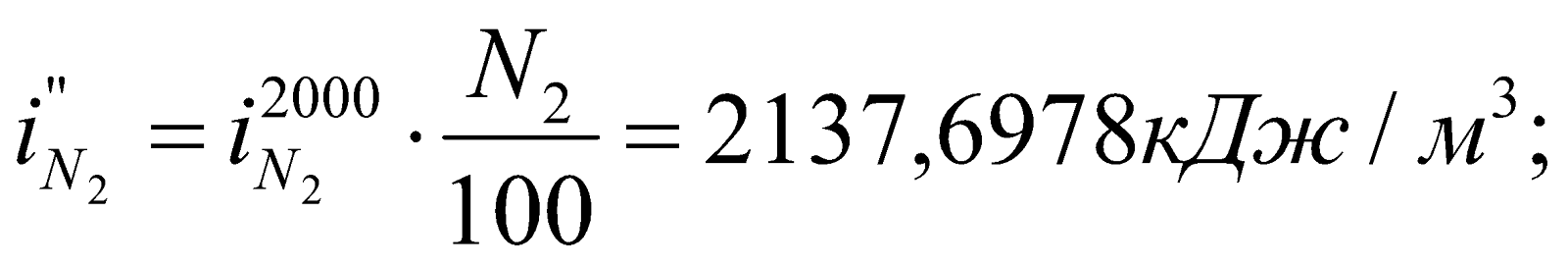
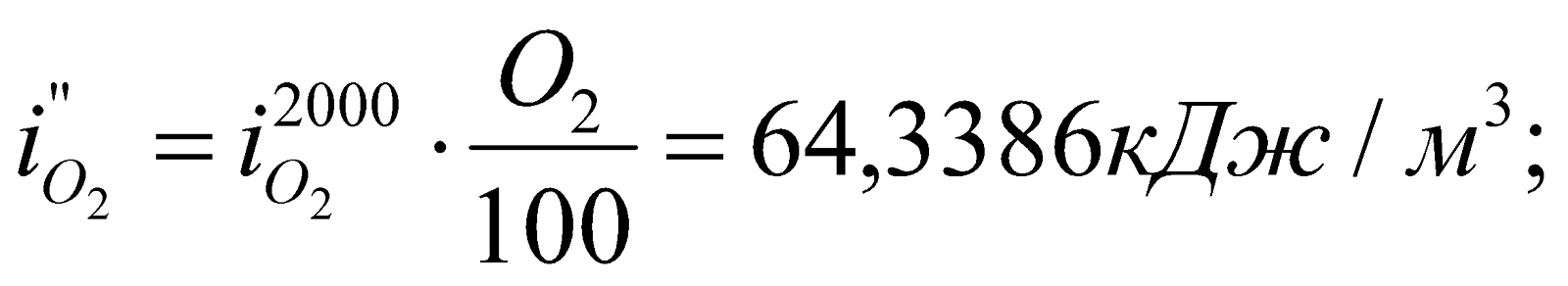
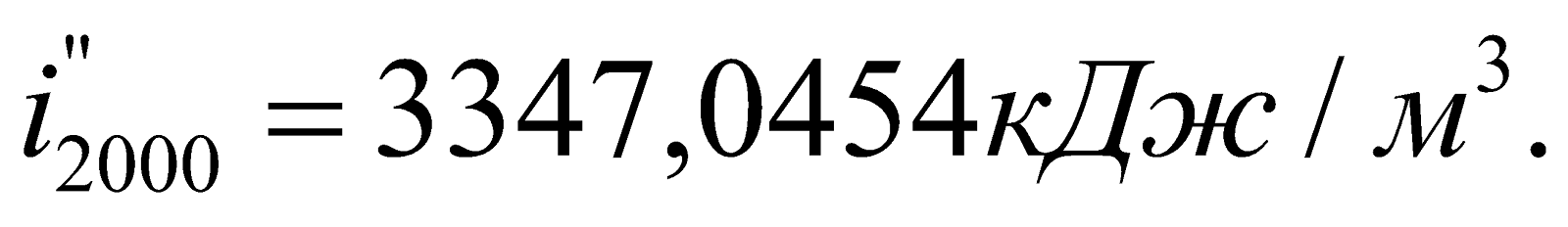
Получилось, что 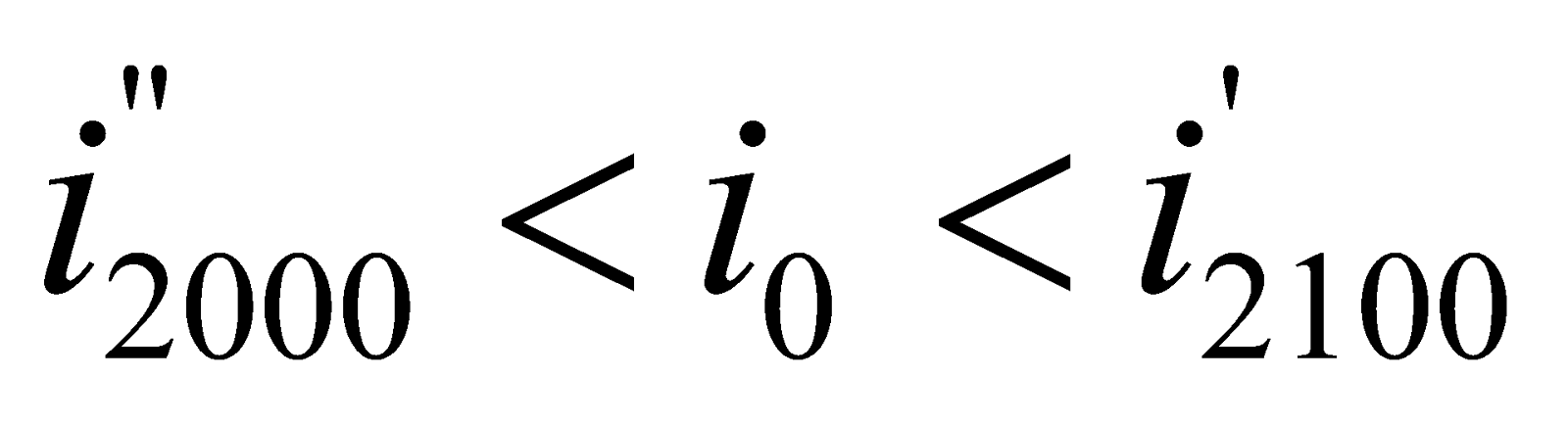 , т.е. действительно калориметрическая температура
, т.е. действительно калориметрическая температура 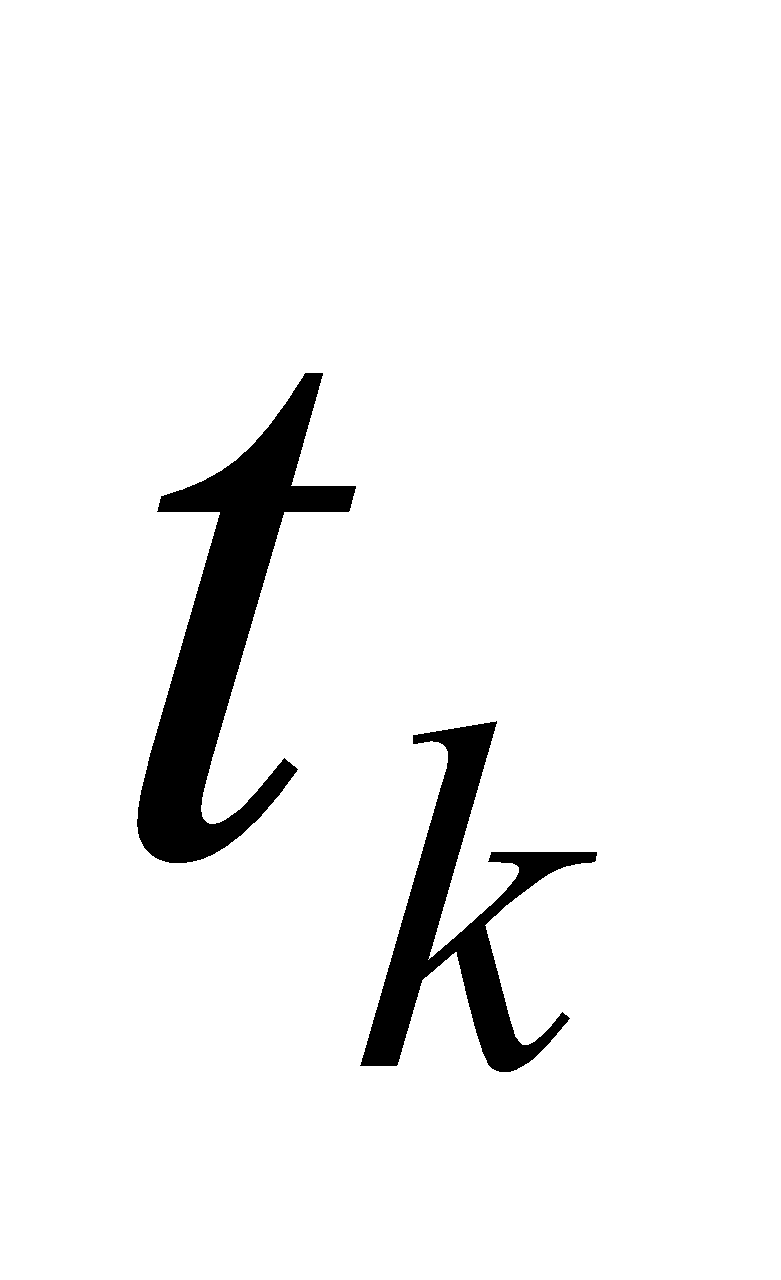 лежит в интервале
лежит в интервале 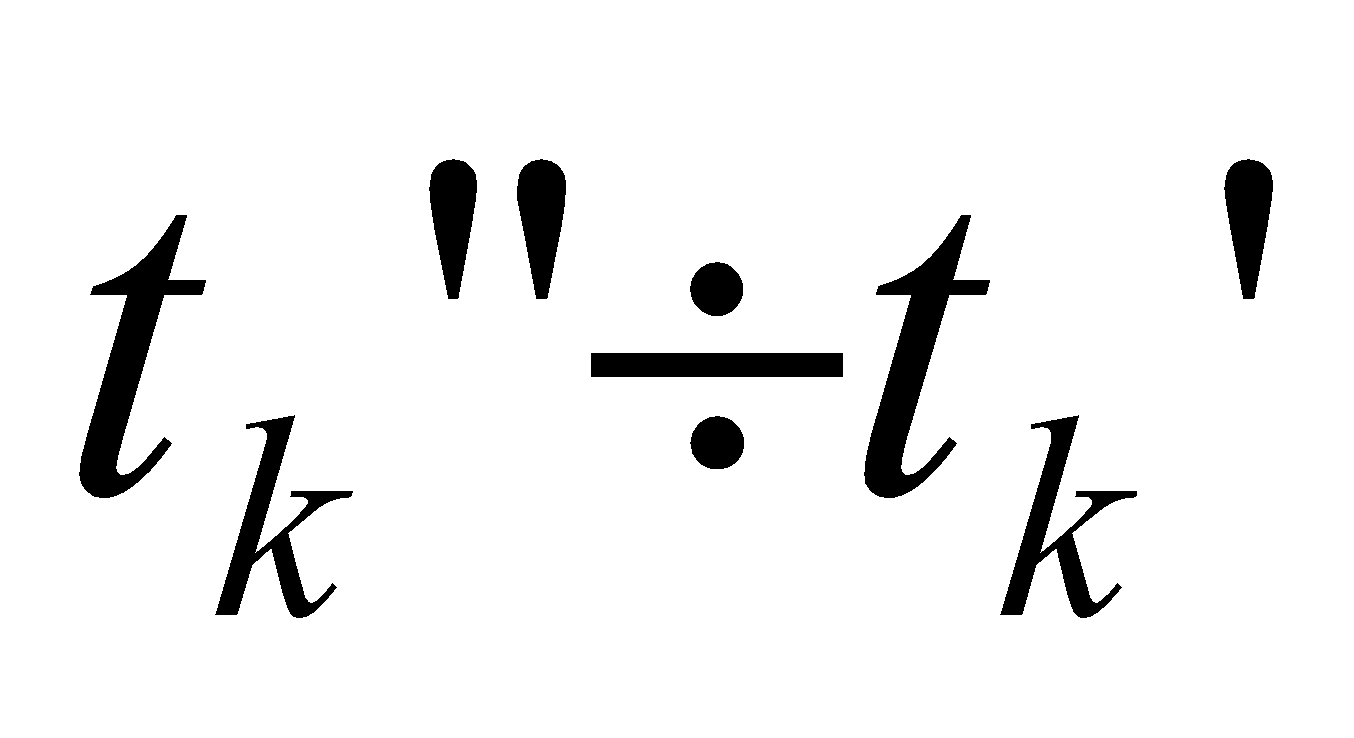 (
(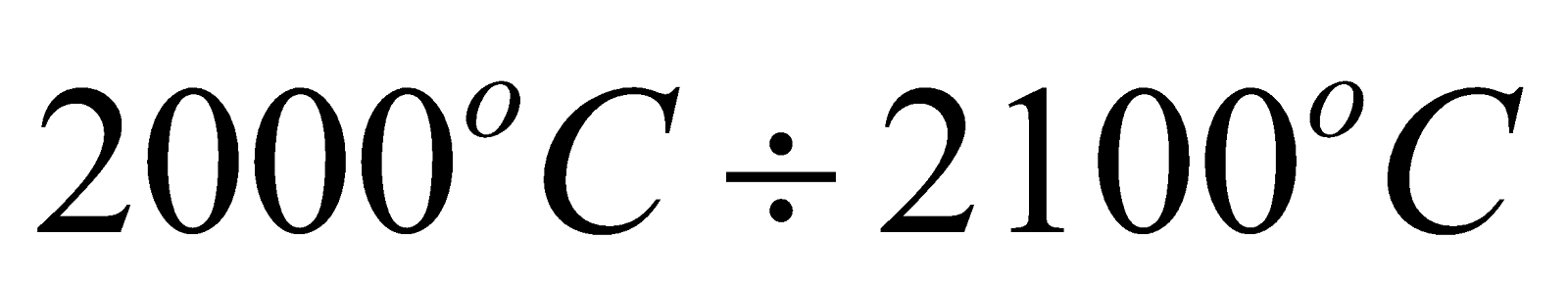 ), которая равна:
), которая равна:
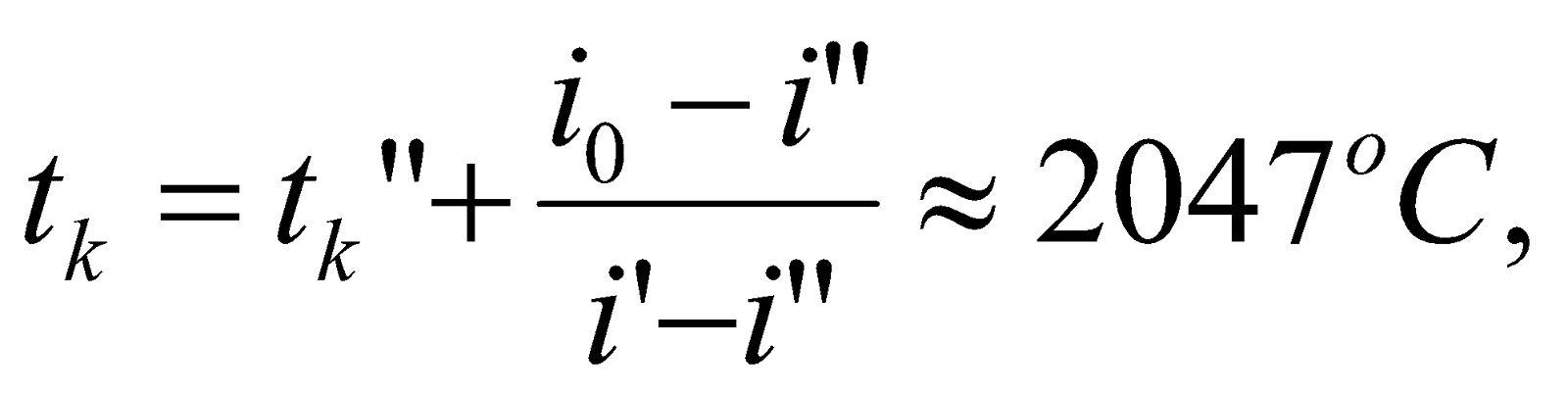 .
.
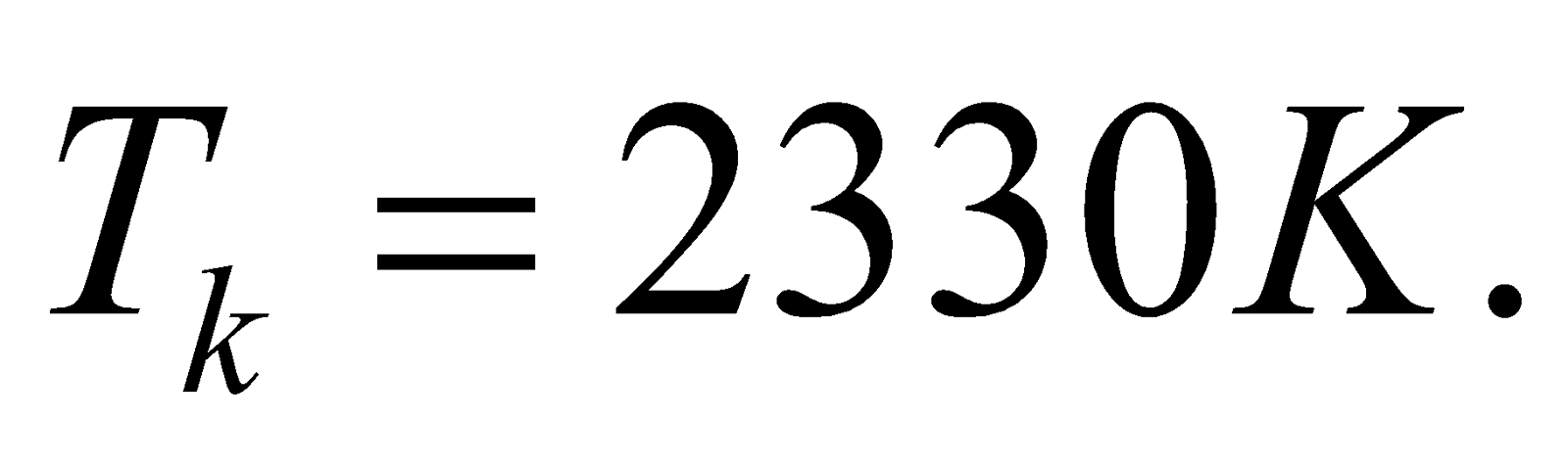
Использованная литература: Расчет горения газообразного топлива. Методические указания к
курсу «Теплотехника». – Алматы.: Минвуз Казахской ССР, 1983. – 32с.